Chemia jest nauką fascynującą, ale czasem może wydawać się skomplikowana. Szczególnie na początku nauki. Jednym z podstawowych zagadnień są wzory sumaryczne kwasów. Zrozumienie ich budowy i zapisu jest kluczowe. Pozwala na dalszą naukę chemii.
Czym są kwasy?
Kwasy to związki chemiczne. Charakteryzują się specyficznymi właściwościami. Mają kwaśny smak (chociaż nie należy ich próbować w laboratorium!). Reagują z metalami. Zmieniają barwę wskaźników (np. lakmusu na czerwono). W roztworach wodnych dysocjują. Oddają jony wodorowe (H+).
Kwasy dzielimy na dwie główne grupy. Są to kwasy tlenowe i beztlenowe. Podział ten wynika z ich budowy. A dokładniej z obecności atomów tlenu.
Kwasy beztlenowe – wzory sumaryczne
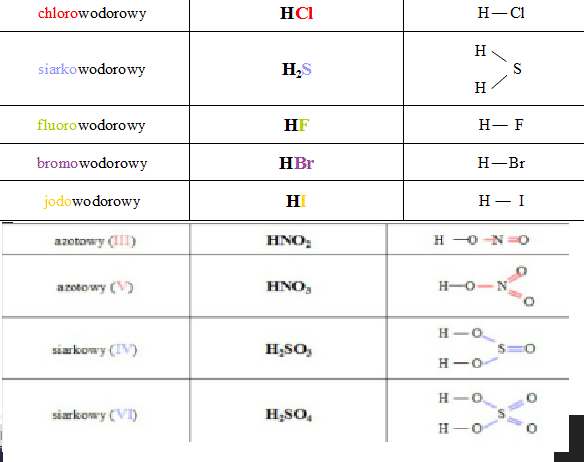
Kwasy beztlenowe to kwasy, które w swojej budowie nie zawierają atomów tlenu. Składają się z atomów wodoru i niemetalu. Do najważniejszych kwasów beztlenowych zaliczamy kwas chlorowodorowy (HCl), kwas bromowodorowy (HBr), kwas jodowodorowy (HI) i kwas siarkowodorowy (H2S).
Wzór sumaryczny kwasu beztlenowego zapisujemy bardzo prosto. Zaczynamy od symbolu wodoru (H). Następnie dopisujemy symbol niemetalu. Liczba atomów wodoru zależy od wartościowości niemetalu. Np. chlor (Cl) jest jednowartościowy, więc wzór kwasu chlorowodorowego to HCl. Siarka (S) jest dwuwartościowa, więc wzór kwasu siarkowodorowego to H2S. Ogólny wzór kwasów beztlenowych to HnX. Gdzie n to wartościowość niemetalu X.
Oto kilka przykładów z objaśnieniami:
- HCl – kwas chlorowodorowy. Chlor jest jednowartościowy.
- HBr – kwas bromowodorowy. Brom jest jednowartościowy.
- HI – kwas jodowodorowy. Jod jest jednowartościowy.
- H2S – kwas siarkowodorowy. Siarka jest dwuwartościowa.
Kwasy tlenowe – wzory sumaryczne
Kwasy tlenowe, w przeciwieństwie do beztlenowych, zawierają w swojej budowie atom tlenu. Składają się z atomów wodoru, niemetalu i tlenu. Wzór sumaryczny kwasu tlenowego jest bardziej złożony. Wymaga znajomości wartościowości pierwiastków. A także znajomości nazw i wzorów tlenków. Tlenki niemetali reagują z wodą. Tworzą kwasy tlenowe.
Ogólny wzór kwasu tlenowego to HnXOm. Gdzie n to liczba atomów wodoru. X to symbol niemetalu. m to liczba atomów tlenu. Liczby n i m zależą od wartościowości niemetalu. A także od stopnia utlenienia niemetalu w danym kwasie.
Wzory sumaryczne kwasów tlenowych ustala się na podstawie wzoru tlenku. Do wzoru tlenku dodajemy cząsteczkę wody (H2O). Np. tlenek siarki(VI) to SO3. Dodając wodę, otrzymujemy H2SO4. Jest to wzór kwasu siarkowego(VI).
Oto kilka przykładów kwasów tlenowych:
- H2SO4 – kwas siarkowy(VI). Powstaje z SO3 + H2O.
- HNO3 – kwas azotowy(V). Powstaje z N2O5 + H2O (po uproszczeniu).
- H3PO4 – kwas fosforowy(V). Powstaje z P2O5 + 3H2O (po uproszczeniu).
- H2CO3 – kwas węglowy. Powstaje z CO2 + H2O.
Stopień utlenienia niemetalu w kwasie
Stopień utlenienia niemetalu w kwasie informuje o jego wartościowości. A także o liczbie elektronów, które atom niemetalu oddał lub przyjął. Do obliczenia stopnia utlenienia wykorzystujemy proste zasady. Wodór ma zawsze stopień utlenienia +I. Tlen ma stopień utlenienia -II. Suma stopni utlenienia wszystkich atomów w cząsteczce musi wynosić zero.
Przykład: Obliczmy stopień utlenienia siarki w kwasie siarkowym(VI) (H2SO4). Wodór (+I) * 2 + Siarka (x) + Tlen (-II) * 4 = 0 2 + x - 8 = 0 x = +6 Stopień utlenienia siarki wynosi +VI. Stąd nazwa kwas siarkowy(VI).
Nazewnictwo kwasów tlenowych
Nazewnictwo kwasów tlenowych jest związane ze stopniem utlenienia niemetalu. Jeśli niemetal występuje na różnych stopniach utlenienia, używamy różnych przedrostków i przyrostków. Najczęściej spotykane są kwasy z końcówkami -owy i -awy. Kwasy z wyższym stopniem utlenienia mają końcówkę -owy (np. kwas siarkowy(VI)). Kwasy z niższym stopniem utlenienia mają końcówkę -awy (np. kwas siarkowy(IV), czyli siarkawy).
Praktyczne zastosowania
Kwasy mają szerokie zastosowanie w przemyśle. Wykorzystuje się je w produkcji nawozów. W syntezie chemicznej. W procesach trawienia metali. W przemyśle spożywczym. Kwas chlorowodorowy (HCl) znajduje zastosowanie w czyszczeniu powierzchni metalowych. Kwas siarkowy (H2SO4) jest używany w akumulatorach samochodowych. Kwas octowy (CH3COOH) to ocet, który używamy w kuchni.
Znajomość wzorów sumarycznych kwasów jest niezbędna. Pozwala na zrozumienie reakcji chemicznych. A także na przewidywanie właściwości związków chemicznych. Chemia staje się wtedy prostsza i bardziej zrozumiała.