Witajcie ósmoklasiści! Przygotowujemy się do sprawdzianu z soli. To bardzo ważny temat w chemii. Zrozumienie soli otwiera drzwi do dalszej wiedzy chemicznej.
Co to są sole?
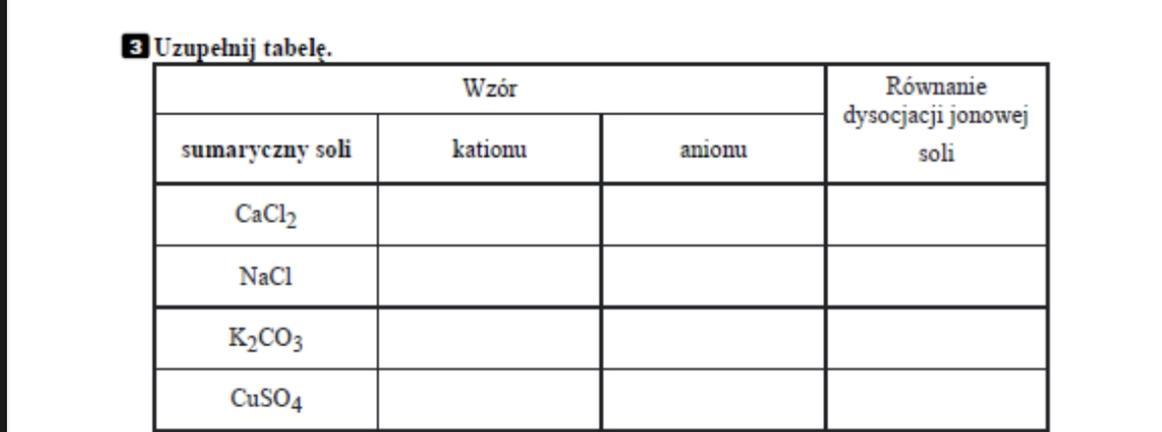
Sole to związki chemiczne. Powstają w wyniku reakcji kwasu z zasadą. Nazywamy to reakcją zobojętniania. Sole składają się z kationu metalu lub kationu amonu i anionu reszty kwasowej.
Na przykład, weźmy kwas solny (HCl) i wodorotlenek sodu (NaOH). Reagują one ze sobą. Powstaje chlorek sodu (NaCl), czyli sól kuchenna, i woda (H2O). To typowy przykład reakcji zobojętniania.
Wzór ogólny soli
Ogólny wzór soli to MxRy. M oznacza kation metalu. R oznacza anion reszty kwasowej. x i y to indeksy stechiometryczne. Mówią nam o liczbie atomów w związku.
Nazewnictwo soli
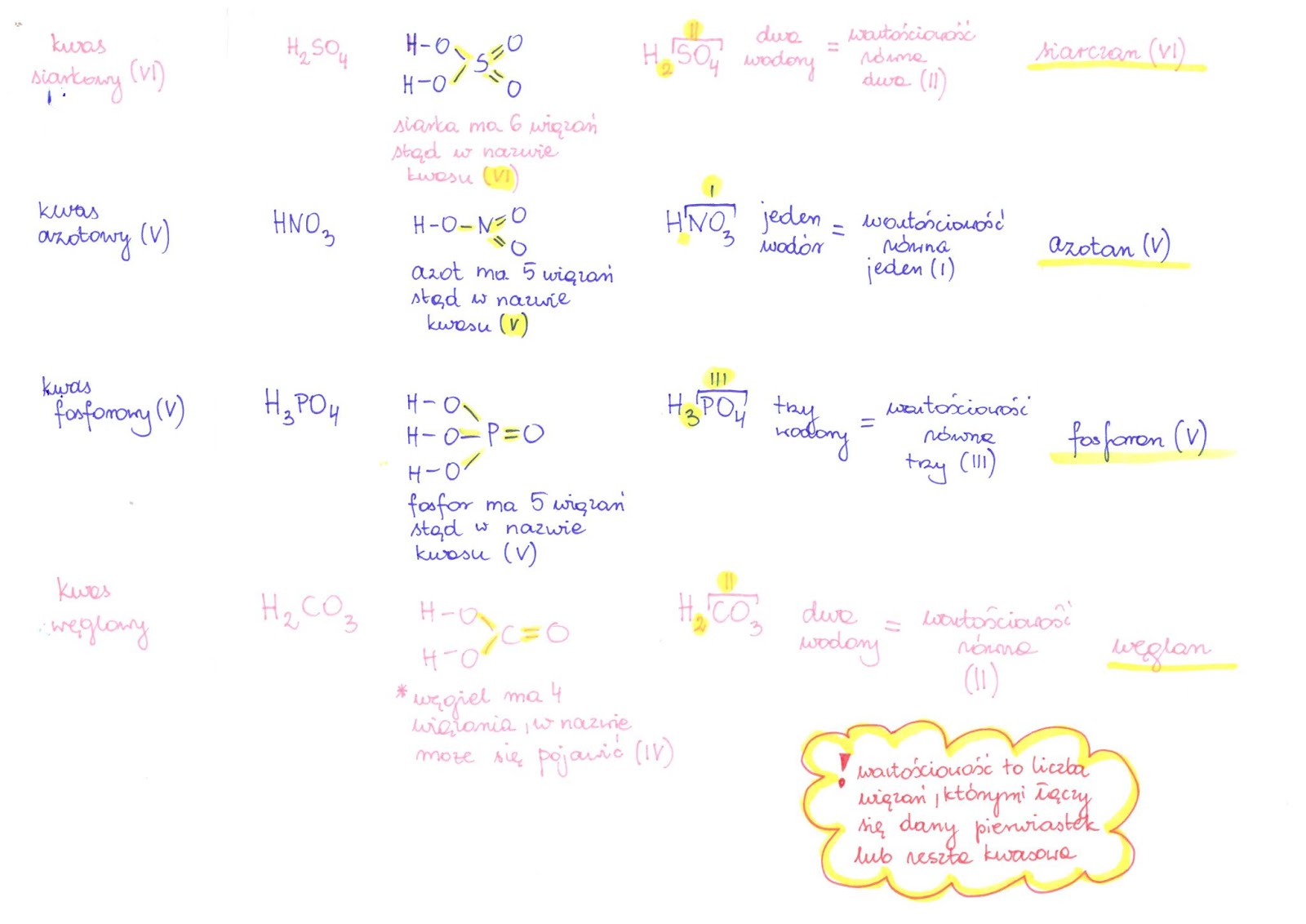
Nazwy soli tworzymy od nazwy reszty kwasowej i nazwy metalu. Na przykład, sól powstała z kwasu siarkowego (VI) (H2SO4) i sodu (Na) to siarczan (VI) sodu (Na2SO4). Ważne jest, aby pamiętać o wartościowości pierwiastków. Od niej zależy wzór sumaryczny soli.
Jeśli metal ma więcej niż jedną wartościowość, podajemy ją w nawiasie po nazwie metalu. Na przykład, chlorek żelaza (II) to FeCl2, a chlorek żelaza (III) to FeCl3. Wartościowość żelaza w pierwszym przypadku wynosi II, a w drugim III.
Rodzaje soli
Mamy różne rodzaje soli. Możemy je klasyfikować ze względu na różne kryteria. Jednym z kryteriów jest pochodzenie od kwasu.
Sole tlenowe
Sole tlenowe pochodzą od kwasów tlenowych. Kwasy tlenowe zawierają w swojej cząsteczce atom tlenu. Przykładem soli tlenowej jest siarczan (VI) potasu (K2SO4). Pochodzi od kwasu siarkowego (VI) (H2SO4).
Sole beztlenowe
Sole beztlenowe pochodzą od kwasów beztlenowych. Kwasy beztlenowe nie zawierają atomów tlenu. Przykładem soli beztlenowej jest chlorek sodu (NaCl). Powstaje od kwasu solnego (HCl).
Wodorosole
Wodorosole zawierają w swojej cząsteczce atom wodoru pochodzący od kwasu. Na przykład, wodorowęglan sodu (NaHCO3) to wodorosól. Powstaje gdy nie wszystkie atomy wodoru w kwasie węglowym (H2CO3) zostaną zastąpione przez metal.
Hydroksosole
Hydroksosole zawierają w swojej cząsteczce grupę hydroksylową (OH-). Na przykład, hydroksychlorek miedzi (II) to hydroksosól. Grupa hydroksylowa pochodzi z zasady.
Właściwości soli
Właściwości soli są różnorodne. Zależą od rodzaju kationu i anionu. Często są to substancje krystaliczne. Mają wysokie temperatury topnienia i wrzenia. Wiele soli dobrze rozpuszcza się w wodzie.
Rozpuszczalność soli w wodzie jest różna. Istnieją tablice rozpuszczalności. Umożliwiają one sprawdzenie, czy dana sól rozpuszcza się w wodzie. Niektóre sole tworzą roztwory nasycone, nienasycone lub przesycone.
Roztwory soli przewodzą prąd elektryczny. Sole dysocjują na jony w wodzie. Jony te przenoszą ładunek elektryczny. Dzięki temu roztwór przewodzi prąd.
Otrzymywanie soli
Sole można otrzymywać różnymi metodami. Najpopularniejsza to reakcja kwasu z zasadą. Ale istnieją inne sposoby.
Reakcja metalu z kwasem
Niektóre metale reagują z kwasami. W wyniku reakcji powstaje sól i wodór. Na przykład, cynk reaguje z kwasem solnym. Powstaje chlorek cynku i wodór.
Reakcja tlenku metalu z kwasem
Tlenki metali reagują z kwasami. W wyniku reakcji powstaje sól i woda. Na przykład, tlenek magnezu reaguje z kwasem siarkowym (VI). Powstaje siarczan (VI) magnezu i woda.
Reakcja zasady z tlenkiem niemetalu
Zasady reagują z tlenkami niemetali. Powstaje sól i woda. Na przykład, wodorotlenek sodu reaguje z tlenkiem węgla (IV). Powstaje węglan sodu i woda.
Reakcja metalu z niemetalem
Niektóre metale reagują bezpośrednio z niemetalami. Tworzą sole beztlenowe. Na przykład, sód reaguje z chlorem. Powstaje chlorek sodu (sól kuchenna).
Zastosowanie soli
Sole mają szerokie zastosowanie. Wykorzystujemy je w różnych dziedzinach życia. Są obecne w przemyśle, medycynie i życiu codziennym.
Chlorek sodu (NaCl) jest stosowany jako sól kuchenna. Używamy jej do przyprawiania potraw. Jest również używana w przemyśle spożywczym. Stosuje się ją do konserwowania żywności. Natomiast w zimie posypujemy drogi. Zapobiega to oblodzeniu.
Węglan sodu (Na2CO3) jest używany w produkcji szkła. Stosuje się go również w produkcji proszków do prania. Jest też wykorzystywany w przemyśle papierniczym.
Siarczan wapnia (CaSO4) jest znany jako gips. Stosuje się go w budownictwie. Używa się go również w medycynie do unieruchamiania złamań.
Azotan potasu (KNO3) jest używany jako nawóz sztuczny. Dostarcza roślinom potas. Potas jest niezbędny do prawidłowego wzrostu.
Nauka o solach jest fascynująca. Mam nadzieję, że ten artykuł pomógł wam w przygotowaniach do sprawdzianu. Pamiętajcie o regularnej nauce i rozwiązywaniu zadań. Powodzenia!