Chemia w klasie 7 wprowadza nas w fascynujący świat atomów. Te malutkie cząsteczki, z których zbudowana jest cała materia, łączą się ze sobą. Powstają w ten sposób cząsteczki i większe struktury.
To, jak atomy się łączą, zależy od ich budowy. Szczególnie ważna jest liczba elektronów na ostatniej powłoce elektronowej. To te elektrony decydują o tym, czy atom chętnie połączy się z innym.
Rodzaje Wiązań Chemicznych
Atomy łączą się ze sobą na różne sposoby. Powstają różne rodzaje wiązań. Najważniejsze z nich to wiązanie jonowe, wiązanie kowalencyjne i wiązanie metaliczne.
Wiązanie Jonowe
Wiązanie jonowe powstaje, gdy jeden atom oddaje elektron drugiemu. Atom, który oddaje elektron, staje się kationem. Ma on ładunek dodatni. Atom, który przyjmuje elektron, staje się anionem. Ma on ładunek ujemny. Przyciąganie elektrostatyczne między kationem a anionem tworzy wiązanie jonowe.
Przykładem związku z wiązaniem jonowym jest chlorek sodu (NaCl), czyli sól kuchenna. Atom sodu (Na) oddaje elektron atomowi chloru (Cl). Powstaje kation sodu (Na+) i anion chlorkowy (Cl-). Przyciągają się one wzajemnie, tworząc kryształ soli.
Związki jonowe mają zwykle wysokie temperatury topnienia i wrzenia. Dobrze rozpuszczają się w wodzie. W roztworach wodnych przewodzą prąd elektryczny.
Wiązanie Kowalencyjne
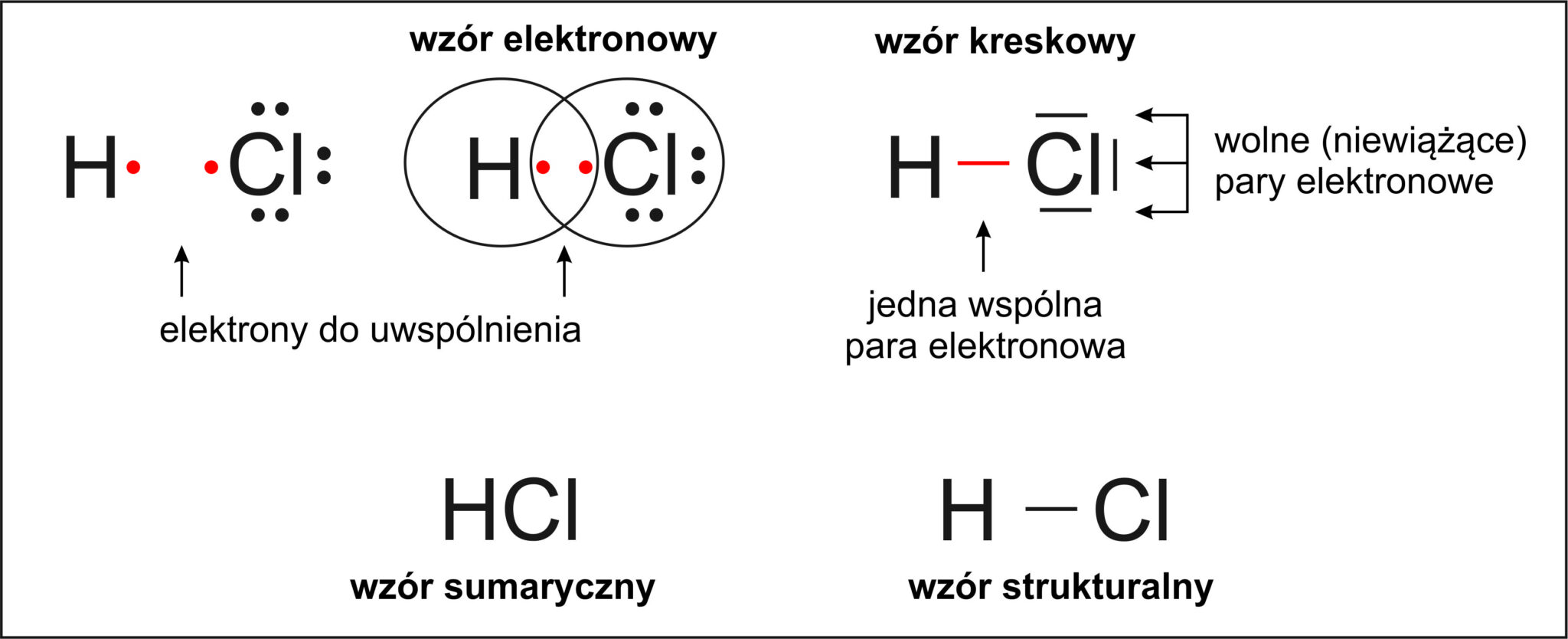
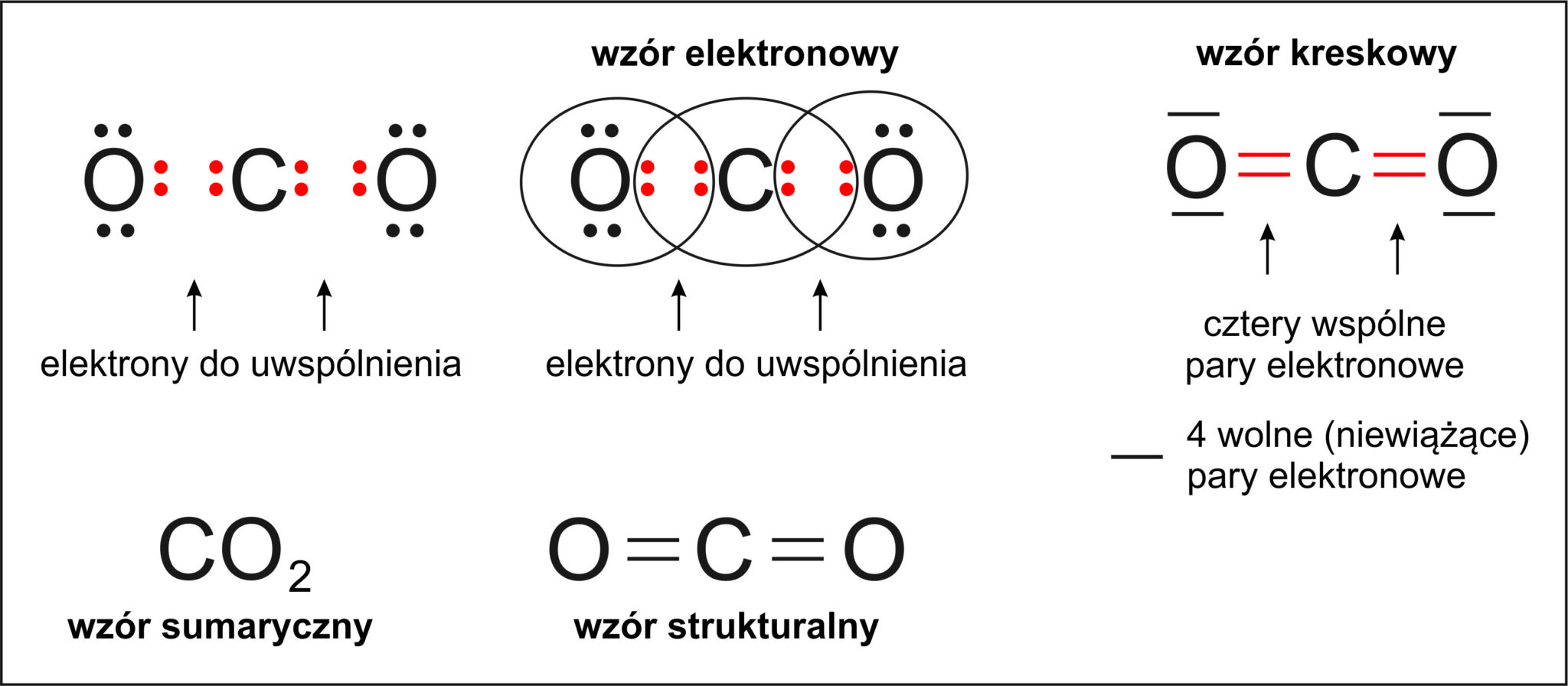
Wiązanie kowalencyjne powstaje, gdy atomy uwspólniają elektrony. Oznacza to, że elektrony krążą wokół obu atomów jednocześnie. Powstaje para elektronowa, która łączy atomy.
Przykładem związku z wiązaniem kowalencyjnym jest woda (H2O). Atom tlenu (O) uwspólnia po jednym elektronie z dwoma atomami wodoru (H). Powstają dwie pary elektronowe, łączące tlen z wodorem.
Wiązanie kowalencyjne może być spolaryzowane lub niespolaryzowane. Jeśli atomy uwspólniające elektrony mają różną elektroujemność, czyli zdolność do przyciągania elektronów, wiązanie jest spolaryzowane. Atom o większej elektroujemności przyciąga elektrony mocniej, stając się częściowo ujemny (δ-). Atom o mniejszej elektroujemności staje się częściowo dodatni (δ+).
Wiązanie kowalencyjne w cząsteczce wody jest spolaryzowane. Tlen jest bardziej elektroujemny niż wodór. Dlatego tlen ma częściowy ładunek ujemny, a wodór częściowy ładunek dodatni.
Związki kowalencyjne mają zwykle niższe temperatury topnienia i wrzenia niż związki jonowe. Często są gazami lub cieczami w temperaturze pokojowej. Niektóre związki kowalencyjne dobrze rozpuszczają się w wodzie, inne słabo.
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach. Atomy metali oddają swoje elektrony walencyjne do wspólnego "morza elektronowego". Elektrony te poruszają się swobodnie po całej strukturze metalu.
Dodatnio naładowane jony metali są zanurzone w tym "morzu elektronowym". Przyciąganie elektrostatyczne między jonami metali a elektronami tworzy wiązanie metaliczne.
Wiązanie metaliczne odpowiada za charakterystyczne właściwości metali. Są to m.in. wysoka przewodność elektryczna i cieplna, kowalność i ciągliwość oraz metaliczny połysk.
Elektroujemność
Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Im wyższa elektroujemność atomu, tym silniej przyciąga on elektrony.
Elektroujemność pierwiastków rośnie w układzie okresowym od lewej do prawej oraz od dołu do góry. Najbardziej elektroujemnym pierwiastkiem jest fluor (F).
Różnica elektroujemności między atomami w wiązaniu chemicznym decyduje o jego charakterze. Duża różnica elektroujemności prowadzi do powstania wiązania jonowego. Mała różnica elektroujemności prowadzi do powstania wiązania kowalencyjnego spolaryzowanego. Brak różnicy elektroujemności prowadzi do powstania wiązania kowalencyjnego niespolaryzowanego.
Praktyczne Zastosowania Wiedzy o Wiązaniach Chemicznych
Wiedza o wiązaniach chemicznych jest bardzo ważna. Pozwala nam zrozumieć właściwości różnych substancji. Możemy przewidywać, jak będą one reagować ze sobą. Możemy projektować nowe materiały o pożądanych właściwościach.
Na przykład, znajomość wiązań chemicznych w tworzywach sztucznych pozwala na ich modyfikację. Możemy tworzyć tworzywa bardziej wytrzymałe, elastyczne lub odporne na wysokie temperatury.
W medycynie wiedza o wiązaniach chemicznych pomaga w projektowaniu leków. Leki muszą wiązać się z odpowiednimi receptorami w organizmie. To połączenie musi być wystarczająco silne, aby lek mógł działać. Jednocześnie musi być na tyle słabe, aby lek mógł się odłączyć po spełnieniu swojej funkcji.
W rolnictwie wiedza o wiązaniach chemicznych pozwala na tworzenie nawozów. Nawozy dostarczają roślinom niezbędne składniki odżywcze. Składniki te muszą być dostępne dla roślin. Muszą też być łatwo przyswajalne.
Zrozumienie wiązań chemicznych jest fundamentem chemii. Umożliwia poznanie budowy materii. Daje narzędzia do tworzenia nowych technologii.