Cześć! Przygotowujesz się do sprawdzianu z chemii? Super! Skupimy się na kwasach, czyli związkach, które często budzą strach, ale wcale nie są takie złe! Szczególnie w 8 klasie!
Pomyśl o kwasach jak o kwaśnych smakach, które znasz.
Co to są kwasy?
Kwasy to związki chemiczne, które, gdy rozpuszczą się w wodzie, oddają jony wodorowe (H+).
Wyobraź sobie baterię. Ma biegun dodatni (+) i ujemny (-). Jon wodorowy to jakby mały, pozytywny ładunek, który "ucieka" z kwasu do wody.
Jak rozpoznać kwas?
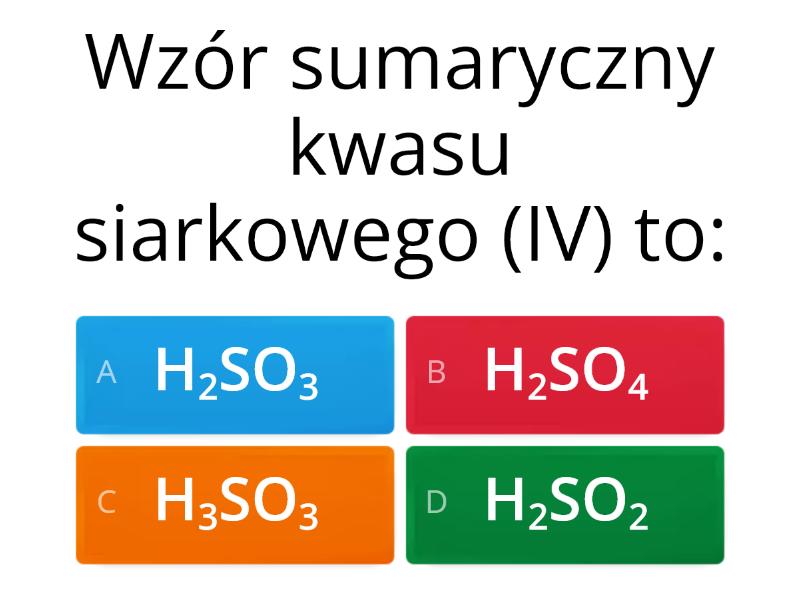
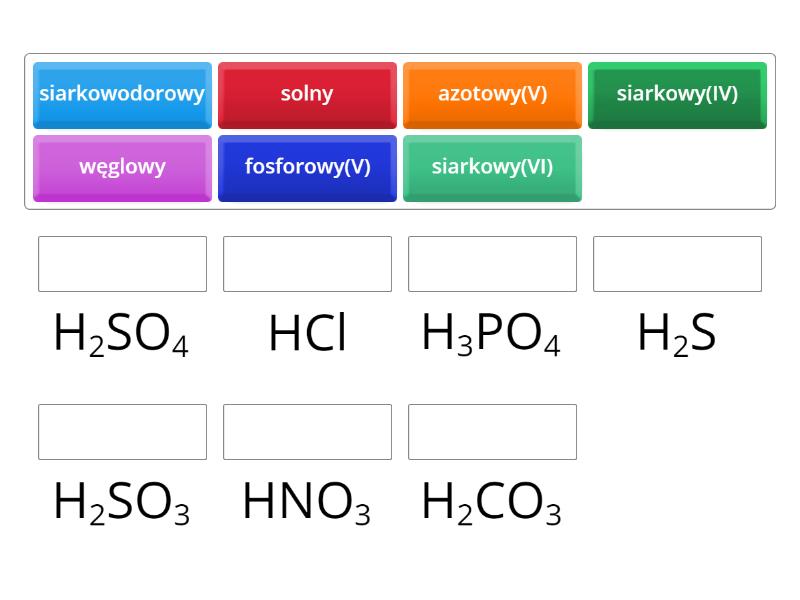
Spójrz na wzór chemiczny. Większość popularnych kwasów ma na początku H, czyli wodór. Np. HCl (kwas solny), H2SO4 (kwas siarkowy).
Pamiętaj jednak, że nie wszystko, co ma "H" na początku, jest kwasem. Woda (H2O) też ma "H", a nie jest kwasem! Kluczem jest to, co dzieje się po rozpuszczeniu w wodzie - czy oddaje jony wodorowe.
Właściwości kwasów
Kwasy mają kilka charakterystycznych cech.
Smak: Kwaśny! Ale nigdy nie próbuj kwasów w laboratorium! Są niebezpieczne.
Działanie na wskaźniki: Zmieniają kolor wskaźników. Wskaźniki to substancje, które reagują na obecność kwasów i zasad, zmieniając barwę.
Wyobraź sobie kameleon, który zmienia kolor w zależności od otoczenia. Wskaźniki działają podobnie!
Papierkiem wskaźnikowy: Zwykle zmienia kolor na czerwony. Pomyśl o "czerwonym alarmie" – kwas!
Fenoloftaleina: Jest bezbarwna w obecności kwasów. Wyobraź sobie szklankę czystej wody – tak wygląda fenoloftaleina w kwasie.
Reakcje z metalami: Niektóre kwasy reagują z metalami, wydzielając wodór. Pamiętasz, jak w filmach naukowych z probówki wydobywa się dym? Czasami to właśnie ta reakcja.
Reakcje z zasadami: Kwasy neutralizują zasady. O tym powiemy więcej za chwilę!
Podział kwasów
Kwasy można podzielić na różne sposoby. Najprostszy podział to na beztlenowe i tlenowe.
Kwasy beztlenowe: Nie zawierają atomów tlenu. Np. HCl (kwas solny), HBr (kwas bromowodorowy).
Kwasy tlenowe: Zawierają atomy tlenu. Np. H2SO4 (kwas siarkowy), HNO3 (kwas azotowy).
Przykłady kwasów i ich zastosowania
Zastanówmy się, gdzie spotykamy kwasy w życiu codziennym.
Kwas solny (HCl): W żołądku! Pomaga trawić jedzenie. Jest też używany w przemyśle, np. do czyszczenia metali.
Kwas siarkowy (H2SO4): W akumulatorach samochodowych! Jest też bardzo ważny w przemyśle chemicznym.
Kwas azotowy (HNO3): Do produkcji nawozów sztucznych i materiałów wybuchowych. Używany też w laboratoriach.
Kwas octowy (CH3COOH): Czyli ocet! Używany w kuchni do przyprawiania potraw i konserwowania.
Kwas cytrynowy (C6H8O7): W cytrynach i innych owocach cytrusowych! Nadaje im kwaśny smak i jest używany jako dodatek do żywności.
Reakcje neutralizacji
Reakcja neutralizacji to reakcja kwasu z zasadą. Powstaje sól i woda.
Wyobraź sobie, że kwas i zasada to dwa magnesy o przeciwnych biegunach. Kiedy się spotkają, "przyciągają się" i neutralizują wzajemnie swoje działanie.
Przykład: HCl (kwas solny) + NaOH (wodorotlenek sodu) → NaCl (chlorek sodu - sól kuchenna) + H2O (woda).
Neutralizacja jest bardzo ważna! Używa się jej np. do leczenia zgagi (nadmiar kwasu w żołądku) – zażywamy leki, które są zasadami, aby zneutralizować kwas.
Bezpieczeństwo
Kwasy są często żrące! Oznacza to, że mogą powodować poważne oparzenia skóry i oczu.
Pamiętaj o kilku zasadach:
Zawsze używaj okularów ochronnych i rękawic, pracując z kwasami.
Nigdy nie wlewaj wody do kwasu! Zawsze wlewaj kwas do wody, powoli i mieszając.
W razie kontaktu kwasu ze skórą lub oczami, natychmiast spłucz dużą ilością wody i skontaktuj się z lekarzem.
Pamiętaj, że chemia może być fascynująca, ale trzeba zachować ostrożność!
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć kwasy. Powodzenia na sprawdzianie!