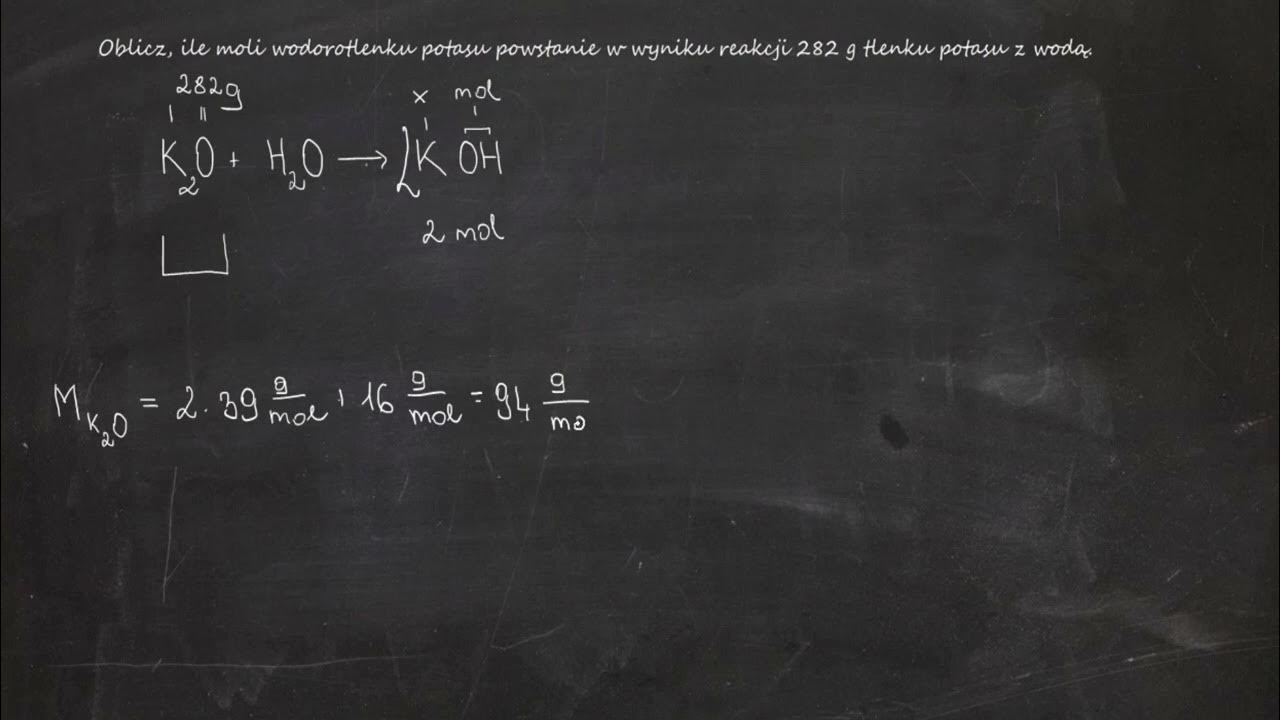Hej! Zastanawiasz się, jak obliczyć masy produktów reakcji rozkładu wody? Świetnie! Zaraz wszystko stanie się jasne.
Czym jest rozkład wody?
To proces, w którym woda (H₂O) rozpada się na dwa gazy: wodór (H₂) i tlen (O₂).
Wyobraź sobie, że masz domek z klocków. Rozkład wody to jak rozłożenie tego domku na pojedyncze klocki.
Co to jest masa?
Masa to ilość materii w danym obiekcie. Mierzymy ją w gramach (g) lub kilogramach (kg).
Pomyśl o wadze. Mówi nam, ile czegoś jest, ile materii zawiera.
Reakcja rozkładu wody - zapis chemiczny
Reakcję rozkładu wody zapisujemy tak:
2 H₂O → 2 H₂ + O₂
Co to oznacza? Dwie cząsteczki wody (2 H₂O) dają nam dwie cząsteczki wodoru (2 H₂) i jedną cząsteczkę tlenu (O₂).
To jak przepis kulinarny. Mówi nam, co i ile potrzebujemy, żeby coś otrzymać.
Masa molowa - co to takiego?
Masa molowa to masa jednego mola danej substancji. Wyrażamy ją w gramach na mol (g/mol).
Mol to jednostka ilości materii. Jeden mol zawiera 6.022 x 10²³ cząsteczek (liczba Avogadro). Dużo, prawda?
Skąd wziąć masę molową? Z układu okresowego pierwiastków! Sprawdzamy masy atomowe pierwiastków.
Masa molowa wody (H₂O)
Masa atomowa wodoru (H) ≈ 1 g/mol
Masa atomowa tlenu (O) ≈ 16 g/mol
Zatem masa molowa H₂O = 2 * 1 g/mol + 16 g/mol = 18 g/mol
Masa molowa wodoru (H₂)
Masa atomowa wodoru (H) ≈ 1 g/mol
Zatem masa molowa H₂ = 2 * 1 g/mol = 2 g/mol
Masa molowa tlenu (O₂)
Masa atomowa tlenu (O) ≈ 16 g/mol
Zatem masa molowa O₂ = 2 * 16 g/mol = 32 g/mol
Obliczanie masy produktów rozkładu 72 g wody
Mamy 72 g wody. Ile wodoru i tlenu otrzymamy?
Zacznijmy od obliczenia liczby moli wody:
Liczba moli H₂O = masa H₂O / masa molowa H₂O = 72 g / 18 g/mol = 4 mole
Czyli mamy 4 mole wody.
Teraz patrzymy na równanie reakcji: 2 H₂O → 2 H₂ + O₂
Z 2 moli wody powstają 2 mole wodoru i 1 mol tlenu.
Skoro mamy 4 mole wody, to:
Powstanie 4 mole wodoru (2 * 2).
Powstanie 2 mole tlenu (1 * 2).
Obliczamy masę wodoru
Masa H₂ = liczba moli H₂ * masa molowa H₂ = 4 mole * 2 g/mol = 8 g
Obliczamy masę tlenu
Masa O₂ = liczba moli O₂ * masa molowa O₂ = 2 mole * 32 g/mol = 64 g
Wynik
Z rozkładu 72 g wody otrzymamy 8 g wodoru i 64 g tlenu.
Sprawdzenie
Czy suma mas produktów daje masę substratu (wody)?
8 g (H₂) + 64 g (O₂) = 72 g
Zgadza się! Prawo zachowania masy potwierdzone!
Prawo zachowania masy
To bardzo ważne prawo w chemii. Mówi, że masa w układzie zamkniętym pozostaje stała w czasie. Masa substratów równa się masie produktów.
Wyobraź sobie, że masz ciasto. Nieważne jak je pokroisz, ilość ciasta (masa) pozostanie taka sama.
Podsumowanie
Aby obliczyć masy produktów reakcji rozkładu, potrzebujesz:
- Zapisać równanie reakcji chemicznej.
- Obliczyć masy molowe substratów i produktów.
- Obliczyć liczbę moli substratu.
- Na podstawie równania reakcji określić liczbę moli produktów.
- Obliczyć masy produktów.
- Sprawdzić, czy masa substratów równa się masie produktów (prawo zachowania masy).
Pamiętaj, chemia to nie magia, tylko logika! Zrozumienie podstawowych pojęć i praw pozwoli Ci rozwiązać każde zadanie.
Mam nadzieję, że teraz wszystko jest jasne! Powodzenia w dalszej nauce chemii!
Kluczowe pojęcia: rozkład, masa, masa molowa, mol, prawo zachowania masy.