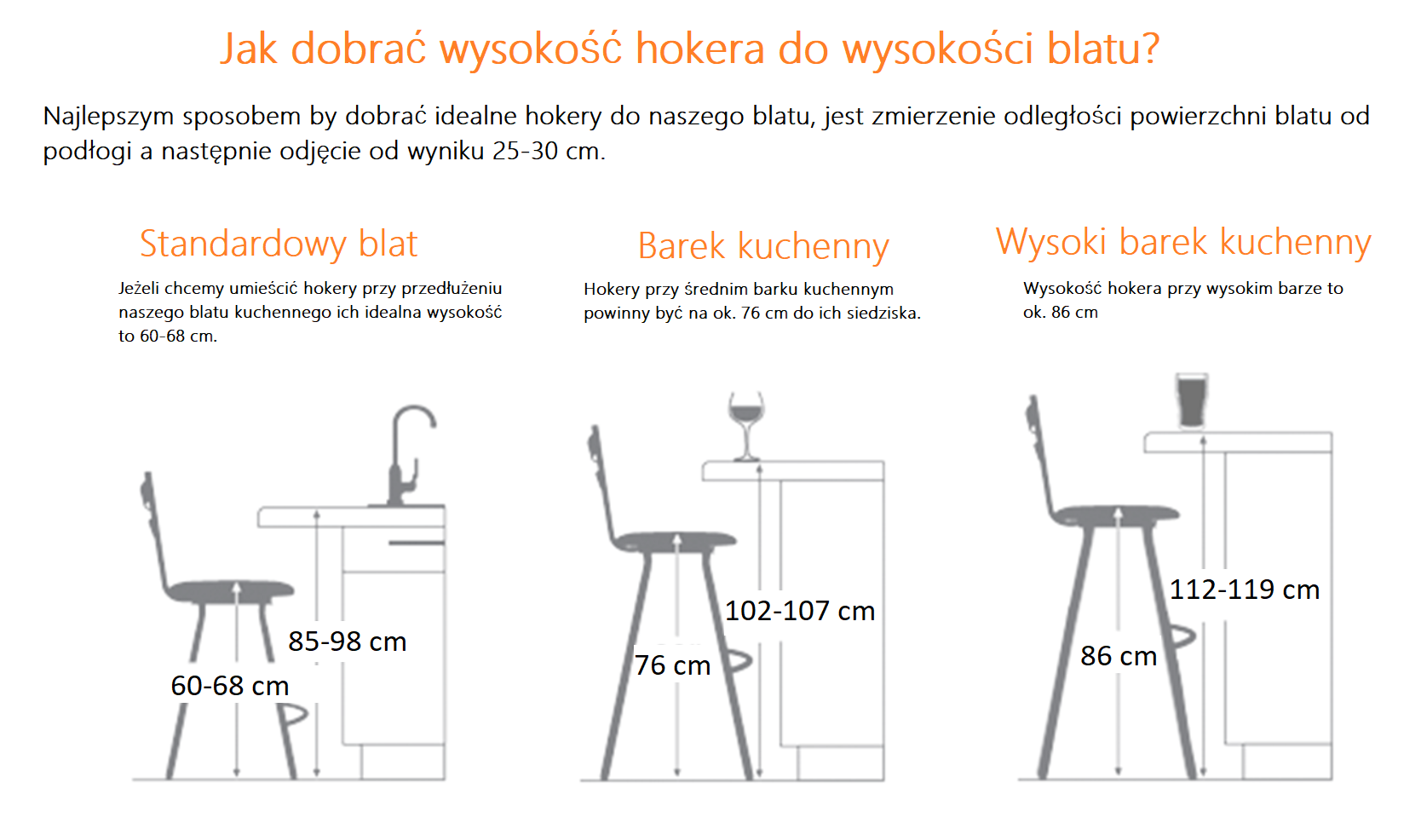
Spróbujmy razem zrozumieć, jak odczytać wartościowość pierwiastka z układu okresowego. To bardzo przydatna umiejętność w chemii.
Czym jest wartościowość?
Wartościowość to liczba wiązań chemicznych, które atom danego pierwiastka może utworzyć z innymi atomami. Mówi nam, ile elektronów atom danego pierwiastka jest w stanie oddać, przyjąć lub uwspólnić podczas tworzenia związku chemicznego.
Innymi słowy, wartościowość określa "zdolność" atomu do łączenia się z innymi atomami.
Układ okresowy a wartościowość
Układ okresowy jest bardzo pomocny w określaniu wartościowości wielu pierwiastków. Istnieją pewne ogólne zasady, które ułatwiają odczytywanie wartościowości. Spójrzmy na poszczególne grupy.
Grupa 1 (litowce)
Pierwiastki z grupy 1 (lit, sód, potas, rubid, cez, frans) mają zazwyczaj wartościowość I. Oznacza to, że tworzą jedno wiązanie chemiczne.
Przykład: Sód (Na) tworzy związek NaCl (chlorek sodu), gdzie ma wartościowość I, a chlor (Cl) też ma wartościowość I.
Grupa 2 (berylowce)
Pierwiastki z grupy 2 (beryl, magnez, wapń, stront, bar, rad) mają zazwyczaj wartościowość II. Oznacza to, że tworzą dwa wiązania chemiczne.
Przykład: Magnez (Mg) tworzy związek MgO (tlenek magnezu), gdzie ma wartościowość II, a tlen (O) ma wartościowość II.
Grupa 13 (borowce)
Pierwiastki z grupy 13 (bor, glin, gal, ind, tal) mają zazwyczaj wartościowość III. Oznacza to, że tworzą trzy wiązania chemiczne.
Przykład: Glin (Al) tworzy związek Al2O3 (tlenek glinu), gdzie ma wartościowość III, a tlen (O) ma wartościowość II.
Grupa 14 (węglowce)
Pierwiastki z grupy 14 (węgiel, krzem, german, cyna, ołów) mogą mieć różne wartościowości, najczęściej IV, ale także II. Węgiel (C) jest bardzo wszechstronny i może tworzyć wiele różnych wiązań.
Przykład: Węgiel (C) w związku CH4 (metan) ma wartościowość IV, a wodór (H) ma wartościowość I.
Grupa 15 (azotowce)
Pierwiastki z grupy 15 (azot, fosfor, arsen, antymon, bizmut) mogą mieć różne wartościowości, najczęściej III i V.
Przykład: Azot (N) w związku NH3 (amoniak) ma wartościowość III, a wodór (H) ma wartościowość I.
Grupa 16 (tlenowce)
Pierwiastki z grupy 16 (tlen, siarka, selen, tellur, polon) mają zazwyczaj wartościowość II.
Przykład: Tlen (O) tworzy związek H2O (woda), gdzie ma wartościowość II, a wodór (H) ma wartościowość I.
Grupa 17 (halogeny)
Pierwiastki z grupy 17 (fluor, chlor, brom, jod, astat) mają zazwyczaj wartościowość I.
Przykład: Chlor (Cl) tworzy związek HCl (kwas solny), gdzie ma wartościowość I, a wodór (H) ma wartościowość I.
Grupa 18 (gazy szlachetne)
Gazy szlachetne (hel, neon, argon, krypton, ksenon, radon) są zazwyczaj niereaktywne i mają wartościowość 0. Oznacza to, że nie tworzą związków chemicznych w normalnych warunkach (choć istnieją wyjątki).
Pierwiastki przejściowe
Pierwiastki przejściowe (znajdujące się w środkowej części układu okresowego) często mają zmienną wartościowość. Oznacza to, że mogą tworzyć związki, w których przyjmują różne wartościowości. Na przykład, żelazo (Fe) może mieć wartościowość II (Fe2+) lub III (Fe3+).
Aby określić wartościowość pierwiastka przejściowego w danym związku, często musimy znać wzór chemiczny i wartościowości innych pierwiastków wchodzących w skład tego związku.
Przykład: W związku FeCl2 (chlorek żelaza(II)), żelazo ma wartościowość II, ponieważ chlor ma wartościowość I, a dwa atomy chloru "równoważą" dwa wiązania żelaza.
W związku FeCl3 (chlorek żelaza(III)), żelazo ma wartościowość III, ponieważ trzy atomy chloru "równoważą" trzy wiązania żelaza.
Jak to działa w praktyce?
Spójrzmy na przykład. Załóżmy, że chcemy określić wartościowość manganu (Mn) w związku KMnO4 (nadmanganian potasu).
- Wiemy, że potas (K) jest w grupie 1 i ma wartościowość I.
- Wiemy, że tlen (O) jest w grupie 16 i ma wartościowość II.
- Mamy jeden atom potasu (wartościowość I), jeden atom manganu (wartościowość nieznana, oznaczmy ją jako x) i cztery atomy tlenu (każdy o wartościowości II).
- Suma wartościowości wszystkich atomów w związku musi wynosić zero (ponieważ związek jest obojętny).
- Zatem: 1 + x + (4 * -2) = 0
- Upraszczamy: 1 + x - 8 = 0
- x - 7 = 0
- x = +7
Zatem mangan (Mn) w związku KMnO4 ma wartościowość VII.
Podsumowanie
Odczytywanie wartościowości z układu okresowego jest bardzo przydatne. Znając położenie pierwiastka w układzie okresowym, możemy często określić jego typową wartościowość. Należy jednak pamiętać, że niektóre pierwiastki, zwłaszcza pierwiastki przejściowe, mogą mieć zmienną wartościowość. W takich przypadkach konieczna jest analiza wzoru chemicznego i wykorzystanie wiedzy o wartościowości innych pierwiastków wchodzących w skład związku.
Pamiętaj, że praktyka czyni mistrza! Im więcej ćwiczysz, tym łatwiej będzie Ci określać wartościowość pierwiastków.