Atom to podstawa chemii. Składa się z kilku ważnych części.
W centrum znajduje się jądro atomowe.
Jądro zawiera protony i neutrony.
Protony mają ładunek dodatni.
Neutrony nie mają ładunku.
Wokół jądra krążą elektrony. Elektrony mają ładunek ujemny.
Liczba protonów decyduje o tym, jaki to pierwiastek.
Jak tłumaczyć budowę atomu?
Użyj modeli! Modele atomów pomagają wizualizować.
Wykorzystaj piłeczki pingpongowe i koraliki.
Wyjaśnij, że to uproszczenie.
Atomy są bardzo małe.
Zacznij od prostych przykładów. Wodór i hel to dobry początek.
Pokaż, jak zmienia się liczba protonów.
Wykorzystaj animacje i filmy edukacyjne.
Dzięki nim uczniowie zobaczą ruch elektronów.
Pamiętaj o analogiach z życia codziennego.
Np. układ słoneczny jako model atomu. Słońce to jądro, planety to elektrony.
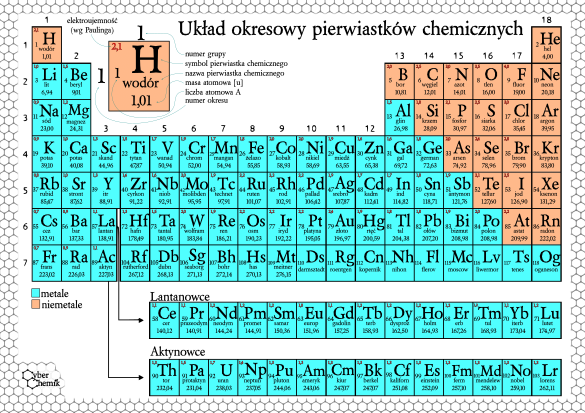
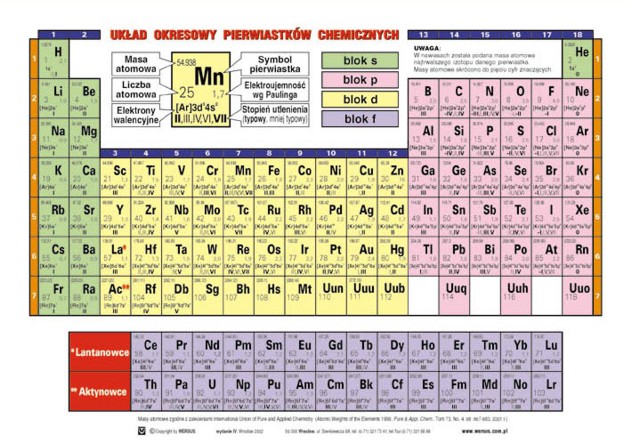
Układ Okresowy Pierwiastków Chemicznych
To tablica, która porządkuje pierwiastki.
Została stworzona przez Dymitra Mendelejewa.
Pierwiastki są uporządkowane według liczby atomowej.
Liczba atomowa to liczba protonów.
Układ okresowy ma grupy i okresy.
Grupy to kolumny.
Okresy to rzędy.
Pierwiastki w tej samej grupie mają podobne właściwości chemiczne.
Jak tłumaczyć układ okresowy?
Wyjaśnij, że to "ściąga" dla chemików.
Pokazuje, jak pierwiastki są ze sobą powiązane.
Wykorzystaj kolorowe tablice układu okresowego.
Podkreśl, że każdy pierwiastek ma swoje miejsce.
Zwróć uwagę na metale, niemetale i półmetale.
Wyjaśnij, że położenie pierwiastka mówi o jego właściwościach.
Pokaż przykłady zastosowania pierwiastków.
Sód w soli kuchennej. Żelazo w stali. Tlen w powietrzu.
Wykorzystaj gry i quizy.
Dzięki nim uczniowie zapamiętają nazwy i symbole pierwiastków.
Typowe błędy i nieporozumienia
Uczniowie często myślą, że elektrony krążą po orbitach.
To uproszczenie. Elektrony poruszają się w orbitalach.
Inny błąd to mylenie atomu z cząsteczką.
Atom to pojedynczy składnik. Cząsteczka to połączenie atomów.
Uczniowie mogą myśleć, że wszystkie atomy danego pierwiastka są identyczne.
Istnieją izotopy. Mają różną liczbę neutronów.
Ważne jest, aby wyjaśnić różnicę między masą atomową a liczbą atomową.
Masa atomowa uwzględnia masy protonów i neutronów.
Liczba atomowa to tylko liczba protonów.
Sprawdzian
Sprawdzian powinien sprawdzać zrozumienie podstaw.
Pytania o budowę atomu: protony, neutrony, elektrony.
Pytania o układ okresowy: grupy, okresy, liczba atomowa.
Zadania na rozpoznawanie pierwiastków po symbolach.
Zadania na określanie liczby protonów, neutronów i elektronów.
Pytania otwarte sprawdzające zrozumienie koncepcji.
Np. "Wyjaśnij, dlaczego pierwiastki w tej samej grupie mają podobne właściwości."
Użyj diagramów i rysunków w sprawdzianie.
Uczniowie mogą uzupełniać luki w diagramach atomów.
Zastosuj różne rodzaje zadań.
Test wyboru, prawda/fałsz, dopasowywanie.
Sprawdzian powinien być dostosowany do poziomu uczniów.
Nie powinien być zbyt trudny, aby nie zniechęcić.
Jak uczynić temat bardziej angażującym?
Zorganizuj eksperymenty. Proste reakcje chemiczne.
Wykorzystaj gry edukacyjne online.
Zaproponuj uczniom tworzenie modeli atomów z różnych materiałów.
Stwórz konkurs na najlepszy model układu okresowego.
Zorganizuj debatę na temat zastosowania pierwiastków w różnych dziedzinach.
Zapraszaj gości - chemików lub inżynierów.
Pokaż, jak chemia jest ważna w życiu codziennym.
Opowiadaj o odkryciach naukowych związanych z atomami i pierwiastkami.
Dzięki temu uczniowie zobaczą, że chemia to fascynująca dziedzina.
Pamiętaj o pochwałach i nagrodach za dobre wyniki.
To motywuje do dalszej nauki.
Ważne jest, aby uczyć z pasją i entuzjazmem.
To zaraża uczniów.
Powodzenia!