Wodorotlenki to związki chemiczne, które zawierają w swojej strukturze grupę hydroksylową (OH-). Ta grupa funkcyjna nadaje im charakterystyczne właściwości. Możemy je traktować jako związki powstałe w wyniku zastąpienia jednego lub więcej atomów wodoru w cząsteczce wody (H2O) przez atom metalu. Są to związki jonowe, składające się z kationów metali i anionów hydroksylowych.
Definicja i wzór ogólny
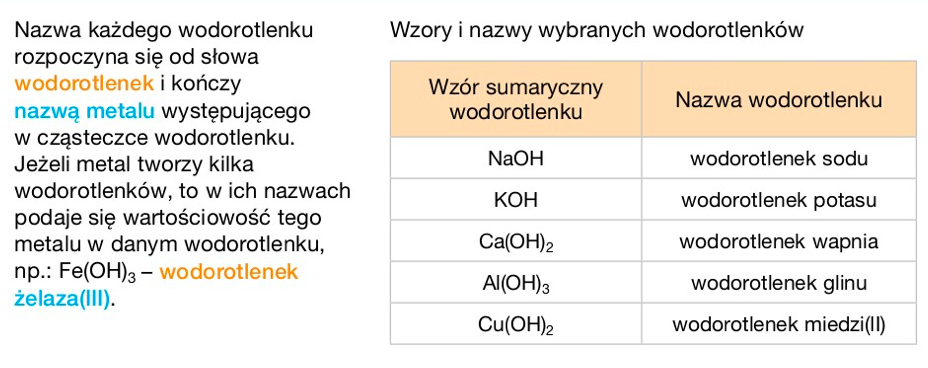
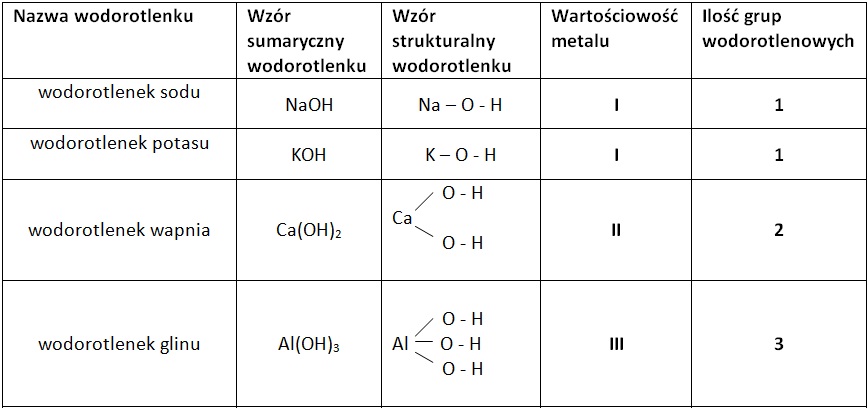
Wodorotlenek to związek chemiczny, którego cząsteczka zawiera kation metalu i aniony wodorotlenkowe (OH-). Ogólny wzór wodorotlenku to M(OH)n, gdzie M to symbol metalu, a n to wartościowość metalu. Wartość n odpowiada liczbie grup wodorotlenkowych przyłączonych do metalu.
Na przykład, wodorotlenek sodu (NaOH) ma jeden anion wodorotlenkowy, ponieważ sód (Na) jest jednowartościowy. Z kolei wodorotlenek wapnia (Ca(OH)2) ma dwa aniony wodorotlenkowe, ponieważ wapń (Ca) jest dwuwartościowy. Zrozumienie wzoru ogólnego pozwala na poprawne zapisywanie i odczytywanie nazw wodorotlenków.
Nazywanie wodorotlenków
Nazewnictwo wodorotlenków jest proste. Nazwę tworzy się od słowa "wodorotlenek" i nazwy metalu w dopełniaczu. Jeżeli metal występuje na różnych stopniach utlenienia, podaje się je w nawiasie za nazwą metalu, używając cyfr rzymskich. Na przykład, NaOH to wodorotlenek sodu, a Fe(OH)2 to wodorotlenek żelaza(II).
Czasami, szczególnie w starszej literaturze, można spotkać nazwy zwyczajowe. Np. NaOH jest znany jako soda kaustyczna. Jednak nazwy systematyczne są bardziej precyzyjne i zalecane w nomenklaturze chemicznej. Znajomość obu rodzajów nazw jest przydatna.
Właściwości wodorotlenków
Właściwości wodorotlenków zależą od metalu, z którym są połączone. Wodorotlenki metali z grup 1 i 2 układu okresowego (np. NaOH, KOH, Ca(OH)2) są zazwyczaj zasadami, które dobrze rozpuszczają się w wodzie. Roztwory te mają odczyn zasadowy, co oznacza, że ich pH jest większe niż 7. Wodorotlenki metali przejściowych są zazwyczaj nierozpuszczalne w wodzie i mają charakter amfoteryczny lub zasadowy.
Wodorotlenki reagują z kwasami, tworząc sole i wodę w reakcji neutralizacji. Reakcja ta jest egzotermiczna, co oznacza, że wydziela się ciepło. Wodorotlenki reagują również z niektórymi solami, tworząc nowe wodorotlenki i sole, jeśli nowo powstały wodorotlenek jest nierozpuszczalny. Rozpuszczalne wodorotlenki (zasady) są żrące i należy obchodzić się z nimi ostrożnie.
Otrzymywanie wodorotlenków
Wodorotlenki można otrzymać na kilka sposobów. Jednym z najprostszych jest reakcja aktywnego metalu z wodą. Na przykład, sód reaguje z wodą, tworząc wodorotlenek sodu i wodór: 2Na + 2H2O → 2NaOH + H2. Innym sposobem jest reakcja tlenku metalu z wodą. Na przykład, tlenek wapnia reaguje z wodą, tworząc wodorotlenek wapnia: CaO + H2O → Ca(OH)2.
Można także otrzymać wodorotlenki w reakcji soli z zasadą. Jeżeli sól i zasada są rozpuszczalne, a w wyniku reakcji powstaje nierozpuszczalny wodorotlenek, to następuje strącanie wodorotlenku. Na przykład: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Strzałka w dół oznacza, że wodorotlenek żelaza(III) wytrąca się z roztworu.
Przykłady i zastosowania wodorotlenków
Wodorotlenek sodu (NaOH), znany również jako soda kaustyczna, jest używany w przemyśle chemicznym, papierniczym i włókienniczym. Stosuje się go także do produkcji mydła i detergentów. Wodorotlenek potasu (KOH), zwany potażem kaustycznym, ma podobne zastosowania jak NaOH, ale jest również używany w produkcji miękkiego mydła i elektrolitów do akumulatorów.
Wodorotlenek wapnia (Ca(OH)2), zwany wapnem gaszonym, jest stosowany w budownictwie do produkcji zapraw murarskich i tynków. Używany jest również w rolnictwie do odkwaszania gleby. Wodorotlenek magnezu (Mg(OH)2) jest składnikiem leków zobojętniających kwas żołądkowy. Zastosowania wodorotlenków są bardzo szerokie i obejmują różne dziedziny życia.
Zadania i odpowiedzi – Przykłady
Zadanie 1: Napisz wzór sumaryczny wodorotlenku baru, wiedząc, że bar jest dwuwartościowy.
Odpowiedź: Ba(OH)2
Zadanie 2: Zapisz równanie reakcji wodorotlenku potasu z kwasem solnym (HCl).
Odpowiedź: KOH + HCl → KCl + H2O
Zadanie 3: Jak otrzymać wodorotlenek żelaza(III) w laboratorium?
Odpowiedź: Dodając roztwór wodorotlenku sodu (NaOH) do roztworu chlorku żelaza(III) (FeCl3). Powstaje osad wodorotlenku żelaza(III): FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Zadanie 4: Określ odczyn roztworu wodorotlenku sodu.
Odpowiedź: Zasadowy (pH > 7)
Zadanie 5: Wymień dwa zastosowania wodorotlenku wapnia.
Odpowiedź: Produkcja zapraw murarskich i odkwaszanie gleby.