Zacznijmy od podstaw. Materia to wszystko, co nas otacza. Co ma masę i zajmuje przestrzeń.
Podstawowe składniki materii
Wszystko zbudowane jest z atomów. To najmniejsze części składowe pierwiastka chemicznego. Nie można ich podzielić w zwykłych reakcjach chemicznych.
Atomy łączą się, tworząc cząsteczki. Na przykład cząsteczka wody (H2O) składa się z dwóch atomów wodoru i jednego atomu tlenu.
Pierwiastki to substancje zbudowane z atomów tego samego rodzaju. Przykładem jest złoto (Au) lub żelazo (Fe).
Związki chemiczne powstają, gdy atomy różnych pierwiastków łączą się ze sobą w określonych proporcjach. Na przykład woda (H2O) jest związkiem chemicznym.
Budowa atomu
Atom składa się z jądra i elektronów. Jądro znajduje się w centrum atomu.
W jądrze znajdują się protony i neutrony. Protony mają ładunek dodatni (+). Neutrony są elektrycznie obojętne.
Elektrony krążą wokół jądra. Mają ładunek ujemny (-).
Liczba protonów w jądrze decyduje o tym, jaki to pierwiastek.
Liczba atomowa i masowa
Liczba atomowa to liczba protonów w jądrze atomu. Oznacza się ją literą Z.
Liczba masowa to suma liczby protonów i neutronów w jądrze atomu. Oznacza się ją literą A.
Można obliczyć liczbę neutronów: liczba neutronów = liczba masowa - liczba atomowa (A - Z).
Stany skupienia materii
Materia występuje w trzech podstawowych stanach skupienia: stałym, ciekłym i gazowym.
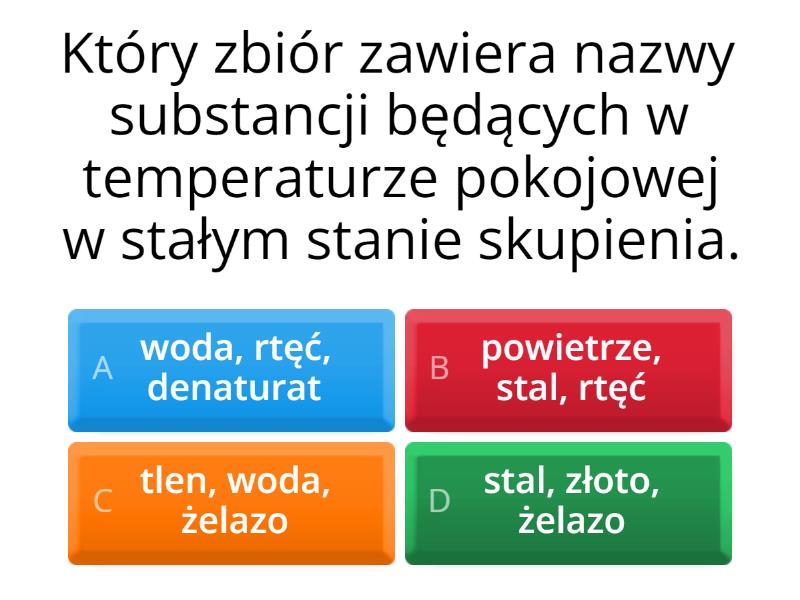
Stan stały charakteryzuje się tym, że substancja ma określony kształt i objętość. Atomy lub cząsteczki są ściśle upakowane i silnie oddziałują ze sobą. Przykładem jest lód.
Stan ciekły charakteryzuje się tym, że substancja ma określoną objętość, ale nie ma określonego kształtu. Przyjmuje kształt naczynia, w którym się znajduje. Atomy lub cząsteczki są bliżej siebie niż w gazie, ale mogą się przemieszczać. Przykładem jest woda.
Stan gazowy charakteryzuje się tym, że substancja nie ma określonego kształtu ani objętości. Rozprzestrzenia się, zajmując całą dostępną przestrzeń. Atomy lub cząsteczki są daleko od siebie i słabo oddziałują ze sobą. Przykładem jest para wodna.
Istnieje także czwarty stan skupienia, zwany plazmą. Plazma to zjonizowany gaz, w którym elektrony są oddzielone od jąder atomowych. Plazma występuje w bardzo wysokich temperaturach, np. w gwiazdach.
Właściwości materii
Materia ma różne właściwości, które można podzielić na fizyczne i chemiczne.
Właściwości fizyczne to te, które można zaobserwować lub zmierzyć bez zmiany składu chemicznego substancji. Należą do nich np.: barwa, zapach, gęstość, temperatura wrzenia, temperatura topnienia, przewodnictwo elektryczne i cieplne.
Właściwości chemiczne to te, które opisują, jak substancja reaguje z innymi substancjami. Należą do nich np.: palność, korozyjność, reaktywność z kwasami lub zasadami.
Przemiany materii
Materia może ulegać przemianom fizycznym i chemicznym.
Przemiany fizyczne to zmiany stanu skupienia lub kształtu substancji, które nie powodują zmiany jej składu chemicznego. Przykładem jest topnienie lodu (zmiana stanu stałego w ciekły) lub wrzenie wody (zmiana stanu ciekłego w gazowy).
Przemiany chemiczne to reakcje, w których substancje przekształcają się w inne substancje. Przykładem jest spalanie drewna (reakcja drewna z tlenem, w wyniku której powstaje dwutlenek węgla, woda i popiół) lub rdzewienie żelaza (reakcja żelaza z tlenem i wodą, w wyniku której powstaje rdza).
Mieszaniny
Mieszanina to połączenie dwóch lub więcej substancji, które nie reagują ze sobą chemicznie.
Mieszaniny mogą być jednorodne lub niejednorodne.
Mieszanina jednorodna to taka, w której składniki są równomiernie rozłożone i nie można ich rozróżnić gołym okiem. Przykładem jest roztwór soli w wodzie.
Mieszanina niejednorodna to taka, w której składniki są nierównomiernie rozłożone i można je rozróżnić gołym okiem. Przykładem jest piasek z wodą.
Składniki mieszaniny można rozdzielić metodami fizycznymi, np. przez sączenie, destylację lub odparowanie.
Prawa chemiczne
Istnieją pewne prawa, które regulują reakcje chemiczne.
Prawo zachowania masy mówi, że masa substancji w zamkniętym układzie pozostaje stała podczas reakcji chemicznej. Masa substratów (substancji wchodzących w reakcję) jest równa masie produktów (substancji powstających w reakcji).
Prawo stałości składu mówi, że dany związek chemiczny zawsze zawiera te same pierwiastki w tych samych proporcjach wagowych.