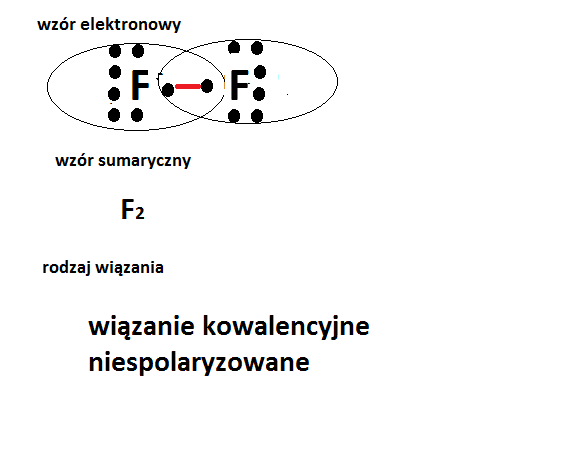Zaczynamy naszą podróż po świecie wiązań chemicznych!
Wiązanie Jonowe
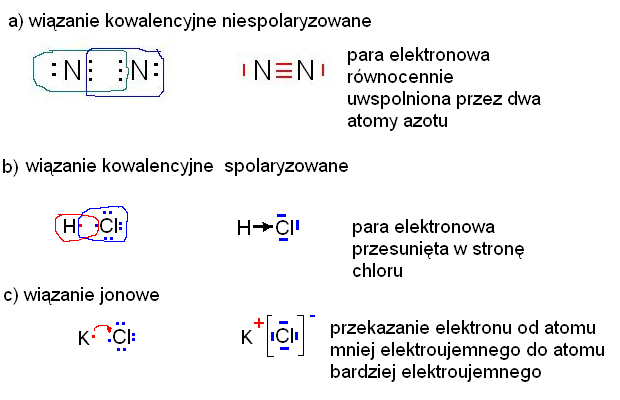
Wiązanie jonowe powstaje, gdy atom oddaje elektron innemu atomowi. Jeden staje się kationem (ładunek dodatni), a drugi anionem (ładunek ujemny).
Różnica w elektroujemności między atomami musi być duża. Najczęściej spotykamy je między metalami a niemetalami.
Przykład? Chlorek sodu (NaCl), czyli sól kuchenna. Sód (Na) oddaje elektron chlorowi (Cl).
Na+ i Cl- przyciągają się elektrostatycznie. Powstaje kryształ jonowy.
Związki jonowe zwykle mają wysoką temperaturę topnienia i wrzenia. Dobrze przewodzą prąd w stanie stopionym lub rozpuszczonym.
Właściwości związków jonowych
Kruchość jest jedną z ich cech charakterystycznych. Uderzenie może przesunąć warstwę jonów, co prowadzi do odpychania i pęknięcia.
Dobrze rozpuszczają się w wodzie. Woda, jako rozpuszczalnik polarny, otacza jony i oddziela je od siebie.
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje przez uwspólnianie elektronów. Atomy dzielą się elektronami, aby osiągnąć stabilną konfigurację elektronową.
Zazwyczaj występuje między niemetalami.
Mamy dwa typy: spolaryzowane i niespolaryzowane.
Wiązanie Kowalencyjne Niespolaryzowane
Wiązanie kowalencyjne niespolaryzowane (nazywane też atomowym) występuje, gdy atomy mają podobną elektroujemność.
Elektrony są równomiernie rozłożone między atomami. Nie powstają ładunki cząstkowe.
Przykładem jest cząsteczka wodoru (H2). Dwa atomy wodoru dzielą się elektronami.
Inne przykłady to cząsteczki takie jak O2, N2 i Cl2.
Wiązania C-H również są często traktowane jako niespolaryzowane, mimo niewielkiej różnicy elektroujemności.
Właściwości związków z wiązaniem kowalencyjnym niespolaryzowanym
Związki te zwykle mają niską temperaturę topnienia i wrzenia.
Słabo rozpuszczają się w wodzie, ale dobrze w rozpuszczalnikach organicznych.
Nie przewodzą prądu elektrycznego.
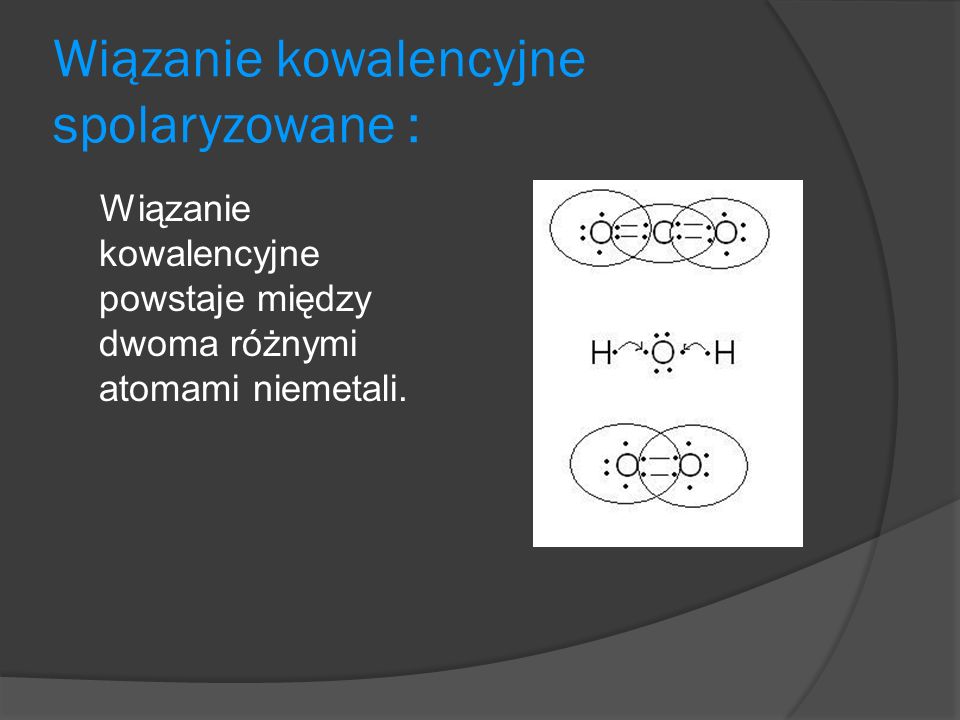
Wiązanie Kowalencyjne Spolaryzowane
Wiązanie kowalencyjne spolaryzowane powstaje, gdy atomy mają różną elektroujemność.
Elektrony są przesunięte w stronę bardziej elektroujemnego atomu. Powstają ładunki cząstkowe (δ+ i δ-).
Na przykład w cząsteczce wody (H2O) tlen jest bardziej elektroujemny niż wodór.
Tlen ma cząstkowy ładunek ujemny (δ-), a wodór cząstkowy ładunek dodatni (δ+).
Inne przykłady to fluorowodór (HF) i amoniak (NH3).
Właściwości związków z wiązaniem kowalencyjnym spolaryzowanym
Związki te mają wyższą temperaturę topnienia i wrzenia niż związki niespolaryzowane.
Mogą rozpuszczać się w wodzie, zwłaszcza jeśli są wystarczająco polarne.
Mogą tworzyć wiązania wodorowe, co wpływa na ich właściwości.
Elektroujemność
Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu chemicznym.
Im większa różnica elektroujemności między atomami, tym bardziej polarne jest wiązanie.
Elektroujemność rośnie w okresie od lewej do prawej i w grupie od dołu do góry układu okresowego.
Fluor (F) jest najbardziej elektroujemnym pierwiastkiem.
Podsumowanie
Wiązanie jonowe: transfer elektronów, duże różnice elektroujemności.
Wiązanie kowalencyjne: uwspólnianie elektronów, mniejsze różnice elektroujemności.
Wiązanie kowalencyjne niespolaryzowane: równomierne rozłożenie elektronów, brak ładunków cząstkowych.
Wiązanie kowalencyjne spolaryzowane: nierównomierne rozłożenie elektronów, obecność ładunków cząstkowych.
Rozumienie tych wiązań jest kluczowe do zrozumienia właściwości chemicznych różnych substancji.
To tylko początek! Chemia to fascynujący świat!