Wiązania chemiczne to siły, które utrzymują atomy razem w cząsteczkach i kryształach. Bez nich materia, jaką znamy, nie mogłaby istnieć. Zrozumienie wiązań chemicznych jest kluczowe w chemii.
Rodzaje Wiązań Chemicznych
Istnieją różne rodzaje wiązań chemicznych. Najważniejsze z nich to wiązania jonowe, wiązania kowalencyjne (w tym wiązania spolaryzowane i niespolaryzowane) oraz wiązania metaliczne. Każde z tych wiązań ma swoje unikalne właściwości i wpływa na charakterystykę substancji.
Wiązanie Jonowe
Wiązanie jonowe powstaje, gdy atom traci elektron(y) i staje się kationem (jonem dodatnim), a inny atom zyskuje elektron(y) i staje się anionem (jonem ujemnym). Przyciąganie elektrostatyczne między tymi przeciwnie naładowanymi jonami tworzy wiązanie jonowe. Jest to typowe dla związków metali z niemetalami.
Przykładem jest chlorek sodu (NaCl), czyli sól kuchenna. Atom sodu (Na) oddaje elektron atomowi chloru (Cl). Powstają jony Na+ i Cl-, które przyciągają się wzajemnie, tworząc sieć krystaliczną. Związki jonowe zazwyczaj charakteryzują się wysokimi temperaturami topnienia i wrzenia, są dobrze rozpuszczalne w wodzie i przewodzą prąd elektryczny w stanie stopionym lub rozpuszczonym.
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje poprzez współdzielenie elektronów między atomami. To wiązanie występuje najczęściej między niemetalami. Atomy "dzielą się" elektronami, aby osiągnąć stabilną konfigurację elektronową.
Istnieją dwa rodzaje wiązań kowalencyjnych: wiązania niespolaryzowane i wiązania spolaryzowane. W wiązaniu niespolaryzowanym elektrony są współdzielone równomiernie między atomami. Dzieje się tak, gdy atomy mają podobną elektroujemność.
Przykładem jest cząsteczka wodoru (H2). Każdy atom wodoru ma jeden elektron, a dzieląc się nimi, oba atomy osiągają konfigurację elektronową helu (2 elektrony). W wiązaniu spolaryzowanym elektrony są przesunięte w stronę atomu o wyższej elektroujemności. To powoduje powstanie częściowego ładunku ujemnego (δ-) na atomie o wyższej elektroujemności i częściowego ładunku dodatniego (δ+) na atomie o niższej elektroujemności.
Przykładem jest woda (H2O). Atom tlenu jest bardziej elektroujemny niż atom wodoru. Dlatego elektrony są przesunięte w stronę tlenu, co powoduje powstanie częściowego ładunku ujemnego na tlenie i częściowych ładunków dodatnich na wodorach. To sprawia, że woda jest rozpuszczalnikiem polarnym.
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach. Polega na oddziaływaniu między kationami metali a "morzem" zdelokalizowanych elektronów. Elektrony walencyjne są swobodnie przemieszczane po całej strukturze metalu.
Dzięki temu metale są dobrymi przewodnikami ciepła i elektryczności. Są również kowalne i ciągliwe, co oznacza, że można je formować w druty i blachy. Przykładem jest miedź (Cu), która jest powszechnie stosowana w instalacjach elektrycznych.
Elektroujemność
Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Im większa różnica elektroujemności między atomami, tym bardziej spolaryzowane jest wiązanie. Elektroujemność rośnie w układzie okresowym w prawo i ku górze (z wyjątkiem gazów szlachetnych).
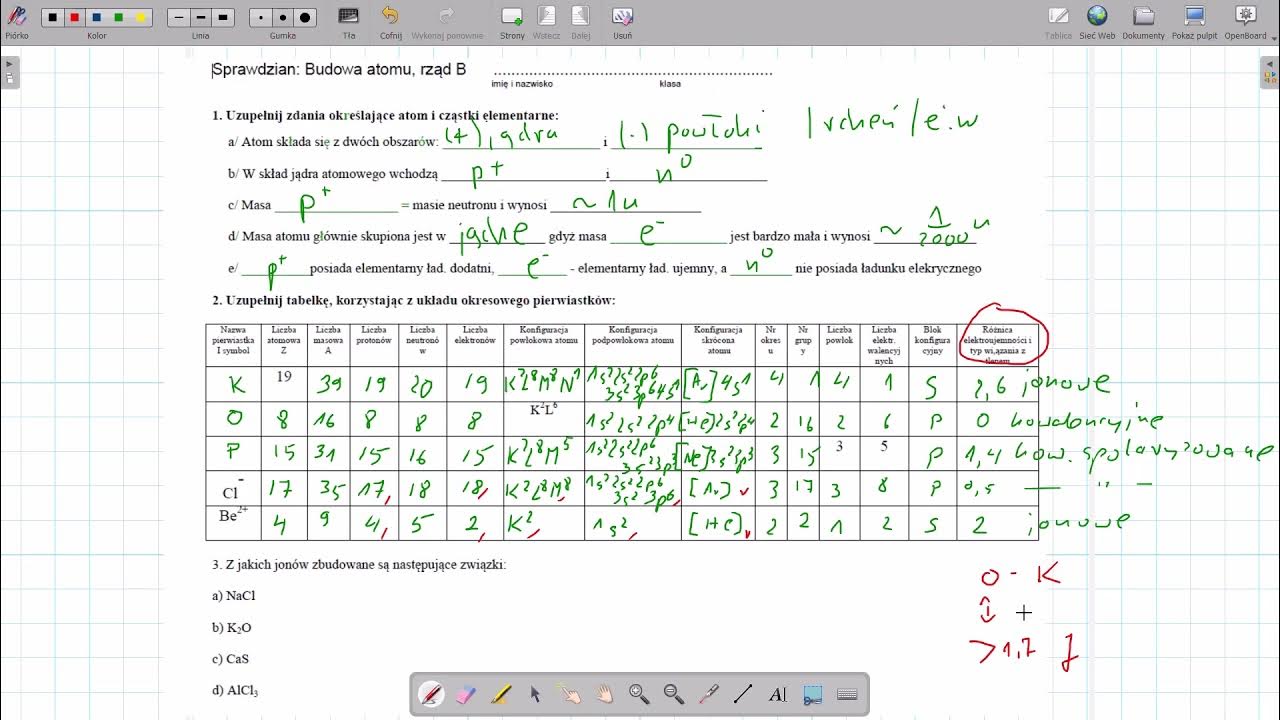
Różnica elektroujemności między atomami pozwala przewidzieć rodzaj wiązania. Duża różnica (zazwyczaj powyżej 1.7) sugeruje wiązanie jonowe. Mała różnica (poniżej 0.4) sugeruje wiązanie kowalencyjne niespolaryzowane. Różnica między 0.4 a 1.7 sugeruje wiązanie kowalencyjne spolaryzowane.
Właściwości Związków Chemicznych a Rodzaj Wiązania
Rodzaj wiązania chemicznego ma ogromny wpływ na właściwości fizyczne i chemiczne substancji. Związki jonowe mają wysokie temperatury topnienia i wrzenia, dobrze rozpuszczają się w rozpuszczalnikach polarnych i przewodzą prąd elektryczny w stanie stopionym lub rozpuszczonym. Związki kowalencyjne mogą mieć różne właściwości, w zależności od polarności wiązania i wielkości cząsteczki. Mogą być gazami, cieczami lub ciałami stałymi o niskich lub umiarkowanych temperaturach topnienia i wrzenia.
Związki metaliczne charakteryzują się dobrą przewodnością cieplną i elektryczną, kowalnością i ciągliwością. Mają zazwyczaj wysokie temperatury topnienia i wrzenia.
Podsumowanie
Wiązania chemiczne to fundamentalne pojęcie w chemii. Zrozumienie różnych rodzajów wiązań chemicznych i ich wpływu na właściwości substancji jest niezbędne do zrozumienia świata wokół nas. Wiązania jonowe, kowalencyjne i metaliczne determinują zachowanie materii i pozwalają na tworzenie różnorodnych związków chemicznych.