Witaj! Porozmawiajmy o wiązaniach chemicznych i oddziaływaniach międzycząsteczkowych.
To bardzo ważne zagadnienia w chemii. Zrozumienie ich pomoże Ci zrozumieć, jak materia otacza nas i jak zachodzi wiele procesów.
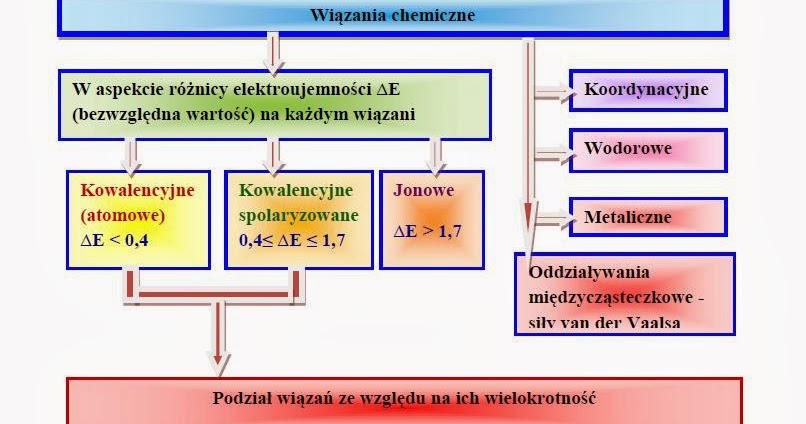
Wiązania Chemiczne
Czym są wiązania chemiczne? To siły, które utrzymują atomy razem w cząsteczkach i kryształach.
Atomy łączą się, aby uzyskać bardziej stabilną konfigurację elektronową. Zwykle dążą do uzyskania oktetu elektronowego na ostatniej powłoce (podobnie do gazów szlachetnych).
Rodzaje Wiązań Chemicznych
Istnieją różne rodzaje wiązań chemicznych. Trzy najważniejsze to: wiązanie jonowe, wiązanie kowalencyjne i wiązanie metaliczne.
Wiązanie Jonowe
Wiązanie jonowe powstaje, gdy jeden atom oddaje elektron(y) drugiemu atomowi. Powstają jony: kation (jon dodatni) i anion (jon ujemny).
Przyciąganie elektrostatyczne między kationem i anionem tworzy wiązanie jonowe.
Przykład: NaCl (chlorek sodu, sól kuchenna). Sód (Na) oddaje elektron chlorowi (Cl), tworząc Na+ i Cl-. Silne przyciąganie elektrostatyczne utrzymuje je razem w kryształ sieci krystalicznej.
Związki jonowe zwykle charakteryzują się wysokimi temperaturami topnienia i wrzenia. Dobrze rozpuszczają się w wodzie (która jest rozpuszczalnikiem polarnym) i przewodzą prąd w stanie stopionym lub roztworze.
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje, gdy atomy uwspólniają elektrony, zamiast je oddawać lub przyjmować.
Elektrony są dzielone między atomami, tworząc orbitale molekularne.
Przykład: H2 (cząsteczka wodoru). Dwa atomy wodoru dzielą się elektronami, tworząc stabilne wiązanie kowalencyjne. Każdy atom wodoru "czuje się", jakby miał dwa elektrony na swojej powłoce walencyjnej (spełnia zasadę duetu).
Wiązania kowalencyjne mogą być polarne lub niepolarne. Wiązanie jest niepolarne, gdy elektrony są równomiernie dzielone między atomami (np. H2). Wiązanie jest polarne, gdy elektrony są bliżej jednego z atomów (np. H2O).
Różnica elektroujemności między atomami determinuje polarność wiązania. Im większa różnica elektroujemności, tym bardziej polarne jest wiązanie.
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach. Atomy metali oddają swoje elektrony walencyjne do wspólnego "morza elektronów".
Te elektrony są delokalizowane i mogą się swobodnie poruszać po całej strukturze metalu.
To "morze elektronów" odpowiada za dobre przewodnictwo elektryczne i cieplne metali, a także za ich plastyczność i kowalność.
Przykład: Żelazo (Fe). Atomy żelaza tworzą sieć krystaliczną, a elektrony walencyjne tworzą "morze elektronów", które je spaja.
Oddziaływania Międzycząsteczkowe
Oddziaływania międzycząsteczkowe to słabsze siły, które oddziałują między cząsteczkami.
Są one odpowiedzialne za właściwości fizyczne substancji, takie jak temperatura wrzenia, temperatura topnienia i lepkość.
Rodzaje Oddziaływań Międzycząsteczkowych
Najważniejsze rodzaje oddziaływań międzycząsteczkowych to: siły van der Waalsa (w tym siły dyspersyjne Londona, oddziaływania dipol-dipol i oddziaływania dipol-indukowany dipol) oraz wiązania wodorowe.
Siły van der Waalsa
Siły van der Waalsa to ogólna nazwa dla słabych oddziaływań międzycząsteczkowych wynikających z fluktuacji gęstości elektronowej w cząsteczkach.
Siły dyspersyjne Londona (znane też jako siły Londona lub siły dyspersyjne) występują między wszystkimi cząsteczkami, nawet niepolarnymi. Powstają one na skutek chwilowych, przypadkowych dipoli, które indukowane są w sąsiednich cząsteczkach.
Oddziaływania dipol-dipol występują między cząsteczkami polarnymi. Cząsteczki polarne mają trwałe dipole i przyciągają się do siebie przeciwnie naładowanymi końcami.
Oddziaływania dipol-indukowany dipol występują między cząsteczką polarną a cząsteczką niepolarną. Cząsteczka polarna indukuje dipol w cząsteczce niepolarnej.
Wiązania Wodorowe
Wiązania wodorowe to silne oddziaływania dipol-dipol, które występują, gdy atom wodoru jest związany z bardzo elektroujemnym atomem (takim jak tlen, azot lub fluor).
Przykład: Woda (H2O). Atom wodoru w jednej cząsteczce wody przyciąga się do atomu tlenu w sąsiedniej cząsteczce wody.
Wiązania wodorowe są odpowiedzialne za wiele niezwykłych właściwości wody, takich jak wysokie napięcie powierzchniowe i wysoka temperatura wrzenia.
Są one również ważne w strukturze białek i DNA.
Podsumowanie
Zrozumienie wiązań chemicznych i oddziaływań międzycząsteczkowych jest kluczowe do zrozumienia właściwości materii.
Wiązania chemiczne (jonowe, kowalencyjne, metaliczne) utrzymują atomy razem w cząsteczkach i kryształach, podczas gdy oddziaływania międzycząsteczkowe (siły van der Waalsa, wiązania wodorowe) wpływają na właściwości fizyczne substancji.
Mam nadzieję, że teraz rozumiesz to lepiej!