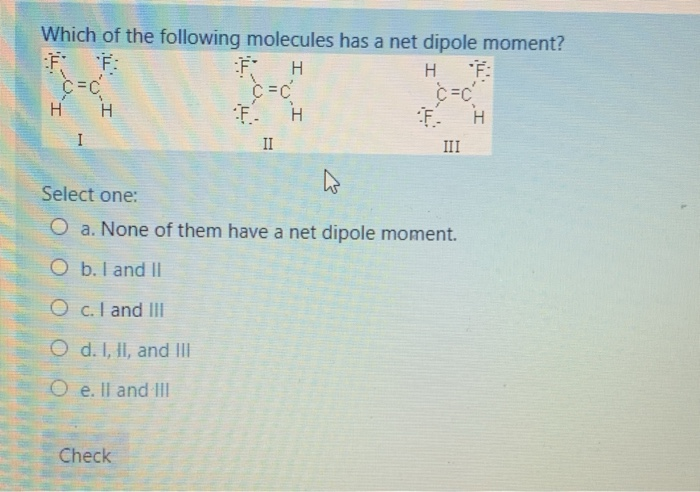
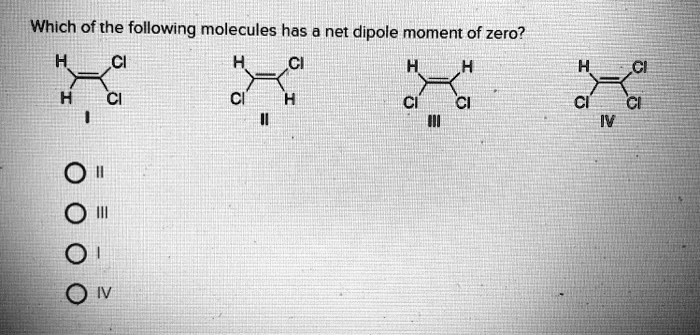
Witaj! Zastanawiasz się, które cząsteczki mają moment dipolowy? To świetnie, bo właśnie to sobie wyjaśnimy!
Moment dipolowy to jakby "nierównomierne rozłożenie ładunku" w cząsteczce.
Wyobraź sobie magnes. Ma biegun północny i południowy. Podobnie cząsteczka z momentem dipolowym ma obszar delikatnie dodatni (δ+) i obszar delikatnie ujemny (δ-).
Ale dlaczego tak się dzieje? Chodzi o elektroujemność atomów.
Elektroujemność: Siła przyciągania elektronów
Elektroujemność to taka "siła" z jaką atom przyciąga elektrony w wiązaniu chemicznym.
Atomy, które bardziej "chcą" elektronów, są bardziej elektroujemne.
Pomyśl o dwóch osobach ciągnących linę. Ta silniejsza przyciągnie linę do siebie. Podobnie atom o wyższej elektroujemności "przyciągnie" elektrony bliżej siebie.
Do najczęstszych pierwiastków elektroujemnych należą: fluor (F), tlen (O), azot (N) i chlor (Cl).
Wiązania polarne i niepolarne
Gdy atomy w wiązaniu mają różną elektroujemność, powstaje wiązanie polarne.
To znaczy, że elektrony spędzają więcej czasu bliżej atomu bardziej elektroujemnego, tworząc wspomniany obszar δ-.
Przykład: Wiązanie O-H w wodzie (H2O). Tlen jest bardziej elektroujemny niż wodór, więc elektrony są bliżej tlenu.
Jeśli atomy w wiązaniu mają taką samą lub bardzo zbliżoną elektroujemność, to mamy wiązanie niepolarne.
Przykład: Wiązanie C-H. Różnica w elektroujemności między węglem a wodorem jest niewielka.
Geometria cząsteczki: Kluczowa sprawa!
Sama obecność wiązań polarnych nie oznacza, że cząsteczka ma moment dipolowy!
Ważna jest geometria cząsteczki – czyli jak te wiązania są ułożone w przestrzeni.
Wyobraź sobie dwie osoby ciągnące linę w przeciwnych kierunkach z tą samą siłą. Lina się nie przesunie, prawda? Siły się znoszą.
Podobnie, jeśli momenty dipolowe wiązań w cząsteczce znoszą się wzajemnie (ze względu na symetryczną geometrię), to cząsteczka jako całość nie ma momentu dipolowego.
Przykłady cząsteczek z momentem dipolowym
Woda (H2O)
Woda ma geometrię zgiętą (kątową). Dwa wiązania O-H są polarne (tlen jest bardziej elektroujemny). Moment dipolowy każdego wiązania O-H skierowany jest w stronę tlenu. Ze względu na geometrię, te momenty nie znoszą się, więc woda ma wyraźny moment dipolowy.
Amoniak (NH3)
Amoniak ma geometrię piramidy trygonalnej. Trzy wiązania N-H są polarne (azot jest bardziej elektroujemny). Momenty dipolowe wiązań N-H sumują się, dając wypadkowy moment dipolowy skierowany w stronę azotu.
Przykłady cząsteczek bez momentu dipolowego
Dwutlenek węgla (CO2)
Dwutlenek węgla ma geometrię liniową. Dwa wiązania C=O są polarne (tlen jest bardziej elektroujemny). Jednak te dwa momenty dipolowe są równe i skierowane w przeciwnych kierunkach, więc znoszą się. CO2 nie ma momentu dipolowego.
Czworochlorek węgla (CCl4)
Czworochlorek węgla ma geometrię tetraedryczną. Cztery wiązania C-Cl są polarne (chlor jest bardziej elektroujemny). Jednak ze względu na symetrię tetraedru, momenty dipolowe wiązań C-Cl znoszą się wzajemnie. Cząsteczka CCl4 jest niepolarna.
Podsumowanie
Aby stwierdzić, czy cząsteczka ma moment dipolowy, musisz wziąć pod uwagę:
- Elektroujemność atomów w wiązaniach.
- Geometrię cząsteczki.
Pamiętaj: Polarne wiązania to dopiero połowa sukcesu! Musisz sprawdzić, czy momenty dipolowe wiązań się sumują, czy znoszą.
Mam nadzieję, że teraz lepiej rozumiesz, jak określić, które cząsteczki mają moment dipolowy! Powodzenia w dalszej nauce!