Zacznijmy od podstaw. Czym jest materia? To wszystko, co nas otacza. Wszystko, co ma masę i zajmuje przestrzeń.
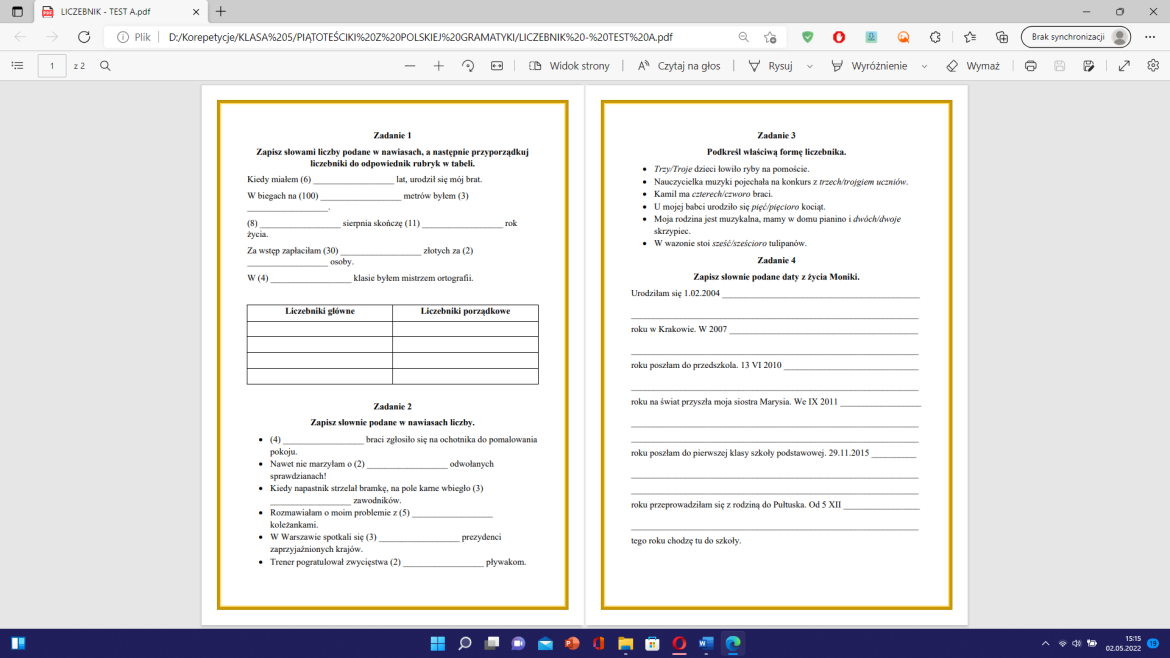
Teraz zajmiemy się wewnętrzną budową materii. Chodzi o to, z czego ta materia jest zbudowana na najmniejszym poziomie. Wyobraź sobie, że masz bardzo mocny mikroskop.
Atomy - Podstawowe Cegiełki
Gdybyśmy mogli przyjrzeć się materii w takim mikroskopie, zobaczylibyśmy atomy. Atomy są podstawowymi jednostkami materii. Można je porównać do cegiełek, z których zbudowane są wszystkie substancje. Każdy atom składa się z jeszcze mniejszych cząstek.
Atomy nie są niepodzielne. Składają się z jądra i elektronów. Jądro atomowe znajduje się w centrum atomu. Jest bardzo małe i gęste. Krążą wokół niego elektrony.
Jądro atomowe składa się z dwóch rodzajów cząstek: protonów i neutronów. Protony mają ładunek dodatni, a neutrony są elektrycznie obojętne. Liczba protonów w jądrze atomowym określa, jaki to pierwiastek.
Protony, Neutrony i Elektrony
Protony, jak wspomnieliśmy, mają ładunek dodatni. Znajdują się w jądrze atomowym. Liczba protonów w jądrze decyduje o tym, jaki to pierwiastek. Na przykład, każdy atom wodoru ma jeden proton.
Neutrony także znajdują się w jądrze atomowym. Nie mają ładunku elektrycznego. Ich obecność wpływa na masę atomu i jego stabilność. Atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Nazywamy je wtedy izotopami.
Elektrony krążą wokół jądra atomowego. Mają ładunek ujemny. Elektrony są bardzo lekkie w porównaniu z protonami i neutronami. Krążą wokół jądra na określonych poziomach energetycznych, zwanych orbitalami lub powłokami elektronowymi.
Pierwiastki i Związki Chemiczne
Pierwiastki to substancje, które składają się z atomów jednego rodzaju. Każdy pierwiastek ma swój symbol chemiczny, np. H – wodór, O – tlen, C – węgiel. Pierwiastki są uporządkowane w układzie okresowym pierwiastków.
Atomy mogą łączyć się ze sobą, tworząc związki chemiczne. Połączenia te nazywamy wiązaniami chemicznymi. Najbardziej powszechne to wiązania kowalencyjne i jonowe. Przykładem związku chemicznego jest woda (H2O), która składa się z dwóch atomów wodoru i jednego atomu tlenu.
Wiązania kowalencyjne powstają, gdy atomy dzielą się elektronami. Wiązania jonowe powstają, gdy jeden atom oddaje elektron drugiemu atomowi, tworząc jony o przeciwnych ładunkach, które się przyciągają.
Molekuły i Kryształy
Molekuły to grupy atomów połączonych wiązaniami chemicznymi. Molekuły mogą składać się z atomów tego samego pierwiastka (np. O2 – tlen cząsteczkowy) lub różnych pierwiastków (np. H2O – woda).
Kryształy to ciała stałe, w których atomy, jony lub molekuły są ułożone w regularny, powtarzający się wzór. Przykładem kryształu jest sól kuchenna (NaCl), gdzie jony sodu (Na+) i chloru (Cl-) są ułożone w sieć krystaliczną.
Struktura krystaliczna wpływa na właściwości fizyczne substancji, takie jak twardość, temperatura topnienia i przewodnictwo elektryczne.
Stany skupienia materii
Materia może występować w trzech podstawowych stanach skupienia: stałym, ciekłym i gazowym. Stan skupienia zależy od sił oddziaływania między atomami lub molekułami oraz od temperatury.
W ciele stałym atomy lub molekuły są ściśle upakowane i mają ustalone położenie. Mają określony kształt i objętość. Przykładem są lód i żelazo.
W cieczy atomy lub molekuły są bliżej siebie niż w gazie, ale mogą się swobodnie przemieszczać. Ciekłe substancje mają określoną objętość, ale nie mają określonego kształtu. Przykładem są woda i olej.
W gazie atomy lub molekuły są bardzo daleko od siebie i poruszają się chaotycznie. Gazy nie mają określonego kształtu ani objętości. Przykładem są powietrze i para wodna.
Istnieje również czwarty stan skupienia materii: plazma. Plazma to zjonizowany gaz, w którym elektrony są oderwane od atomów. Plazma występuje w gwiazdach i piorunach.
Ruch cząsteczek
Nawet w ciałach stałych atomy i molekuły nie są nieruchome. Drgają wokół swoich położeń równowagi. W cieczach i gazach cząsteczki poruszają się w sposób ciągły i chaotyczny. Ten ruch nazywamy ruchem Browna.
Energia kinetyczna cząsteczek zależy od temperatury. Im wyższa temperatura, tym szybciej poruszają się cząsteczki. Dlatego podgrzewanie substancji powoduje zmianę jej stanu skupienia (np. topnienie lodu, wrzenie wody).
Podsumowanie
Wewnętrzna budowa materii jest fascynująca. Atomy, pierwiastki, związki chemiczne, molekuły, kryształy i stany skupienia – to wszystko tworzy złożony i różnorodny świat, który nas otacza. Zrozumienie tych podstawowych pojęć jest kluczem do poznania właściwości materii i jej zachowania.
Pamiętaj, że to tylko wprowadzenie. Istnieje wiele bardziej zaawansowanych zagadnień związanych z budową materii, takich jak mechanika kwantowa, fizyka jądrowa i chemia kwantowa. Jednak solidne zrozumienie tych podstaw pozwoli Ci na dalsze zgłębianie tej fascynującej dziedziny nauki.