Witaj! Przygotowując się do egzaminu z chemii, często spotykamy się z zadaniami związanymi z rozcieńczaniem kwasów. Jednym z częściej pojawiających się pytań jest to, jak zmieszać kwas o danym stężeniu, aby otrzymać roztwór o pożądanym stężeniu. Dziś skupimy się na zadaniu, które prosi o określenie stosunku objętościowego, w jakim należy zmieszać 96% kwas siarkowy, aby uzyskać roztwór o konkretnym, niższym stężeniu. Omówimy to krok po kroku, żebyś mógł bez problemu radzić sobie z podobnymi zadaniami.
Zrozumienie Koncepcji Stężeń i Rozcieńczania
Zanim przejdziemy do konkretnych obliczeń, upewnijmy się, że dobrze rozumiesz podstawowe pojęcia. Stężenie procentowe, o którym mówimy (96% w tym przypadku), informuje nas, ile gramów substancji rozpuszczonej (w tym przypadku kwasu siarkowego, H2SO4) znajduje się w 100 gramach roztworu. Rozcieńczanie polega na dodawaniu rozpuszczalnika (najczęściej wody) do roztworu, co zmniejsza stężenie substancji rozpuszczonej.
Ważne jest, aby pamiętać o zasadzie zachowania masy. Masa substancji rozpuszczonej pozostaje stała podczas rozcieńczania. Oznacza to, że liczba gramów kwasu siarkowego w roztworze przed rozcieńczeniem jest taka sama, jak liczba gramów kwasu siarkowego w roztworze po rozcieńczeniu.
Kluczowe Wzory i Obliczenia
Podstawowym wzorem, który wykorzystujemy przy rozcieńczaniu, jest:
C1V1 = C2V2
Gdzie:
- C1 – stężenie początkowe roztworu
- V1 – objętość początkowa roztworu
- C2 – stężenie końcowe roztworu (po rozcieńczeniu)
- V2 – objętość końcowa roztworu (po rozcieńczeniu)
Jednak to równanie bezpośrednio nie rozwiązuje naszego zadania o stosunku objętościowym. Potrzebujemy zmodyfikować podejście i wprowadzić dodatkowe zmienne.
Rozwiązywanie Zadania z Użyciem Stosunku Objętościowego
Wyobraźmy sobie, że chcemy otrzymać roztwór o stężeniu np. 10% z 96% kwasu siarkowego. Musimy określić, w jakim stosunku zmieszać 96% kwas z wodą (która ma stężenie 0%). Załóżmy, że:
- V1 to objętość kwasu 96%
- V2 to objętość wody
- C1 = 96%
- C2 = 0% (woda)
- Cwyn to pożądane stężenie końcowe np. 10%
- Vwyn = V1 + V2 (objętość końcowa to suma objętości kwasu i wody)
Teraz możemy napisać równanie bilansu masy kwasu:
C1V1 + C2V2 = CwynVwyn
Ponieważ C2 = 0, równanie upraszcza się do:
C1V1 = Cwyn(V1 + V2)
Podstawiamy znane wartości i otrzymujemy:
96% * V1 = 10% * (V1 + V2)
Teraz przekształcamy równanie, aby wyznaczyć stosunek V1 do V2:
96V1 = 10V1 + 10V2
86V1 = 10V2
V1 / V2 = 10 / 86 = 5 / 43
Oznacza to, że aby otrzymać 10% roztwór kwasu siarkowego z 96% kwasu, musimy zmieszać 5 jednostek objętości 96% kwasu z 43 jednostkami objętości wody. Stosunek objętościowy wynosi 5:43.
Przykładowe Zadanie i Rozwiązanie Krok po Kroku
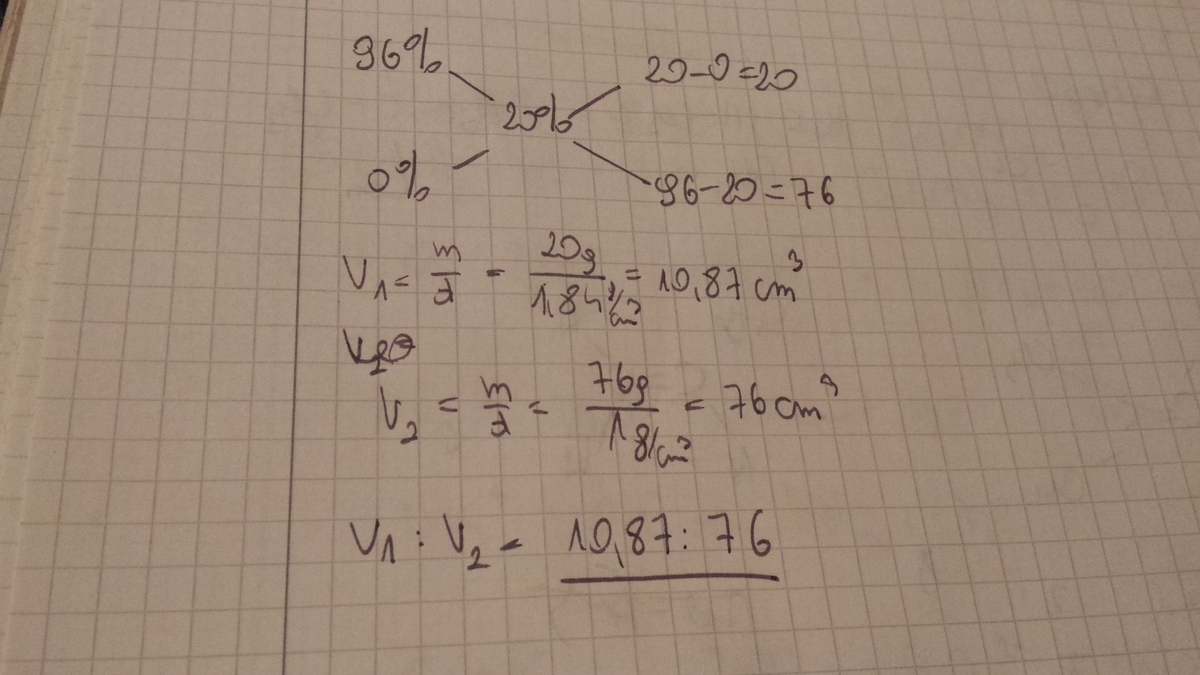
Załóżmy, że chcemy przygotować 20% roztwór kwasu siarkowego, dysponując 96% kwasem. Jaki jest stosunek objętościowy kwasu do wody?
Krok 1: Zapisujemy równanie bilansu masy kwasu:
96V1 = 20(V1 + V2)
Krok 2: Rozwijamy równanie:
96V1 = 20V1 + 20V2
Krok 3: Przenosimy wyrazy z V1 na jedną stronę:
76V1 = 20V2
Krok 4: Wyznaczamy stosunek V1 do V2:
V1 / V2 = 20 / 76 = 5 / 19
Odpowiedź: Należy zmieszać 5 jednostek objętości 96% kwasu siarkowego z 19 jednostkami objętości wody, aby otrzymać 20% roztwór. Stosunek objętościowy wynosi 5:19.
Wskazówki i Triki
- Zawsze sprawdzaj jednostki – upewnij się, że używasz tych samych jednostek objętości (np. ml, litry) dla wszystkich składników.
- Zawsze dodawaj kwas do wody, a nie odwrotnie. Jest to bardzo ważne ze względów bezpieczeństwa, ponieważ reakcja rozcieńczania kwasu jest silnie egzotermiczna (wydziela dużo ciepła). Dodawanie wody do kwasu może spowodować gwałtowne wrzenie i rozpryskiwanie kwasu.
- Sprawdź wynik – po obliczeniach zastanów się, czy wynik ma sens. Jeśli chcesz rozcieńczyć 96% kwas do 10%, oczekujesz, że ilość wody będzie znacznie większa niż ilość kwasu.
Podsumowanie
Aby rozwiązać zadanie dotyczące stosunku objętościowego, w jakim należy zmieszać 96% kwas siarkowy z wodą, aby otrzymać roztwór o określonym stężeniu, należy:
- Zrozumieć koncepcję stężeń i rozcieńczania.
- Użyć wzoru bilansu masy kwasu: C1V1 = Cwyn(V1 + V2), gdzie C1 to stężenie początkowe kwasu, V1 to objętość kwasu, Cwyn to pożądane stężenie końcowe, a V2 to objętość wody.
- Przekształcić równanie, aby wyznaczyć stosunek V1 / V2.
- Pamiętać o zasadach bezpieczeństwa i zawsze dodawać kwas do wody.
Pamiętaj, praktyka czyni mistrza! Rozwiąż kilka podobnych zadań, aby utrwalić wiedzę i zyskać pewność siebie przed egzaminem. Powodzenia!