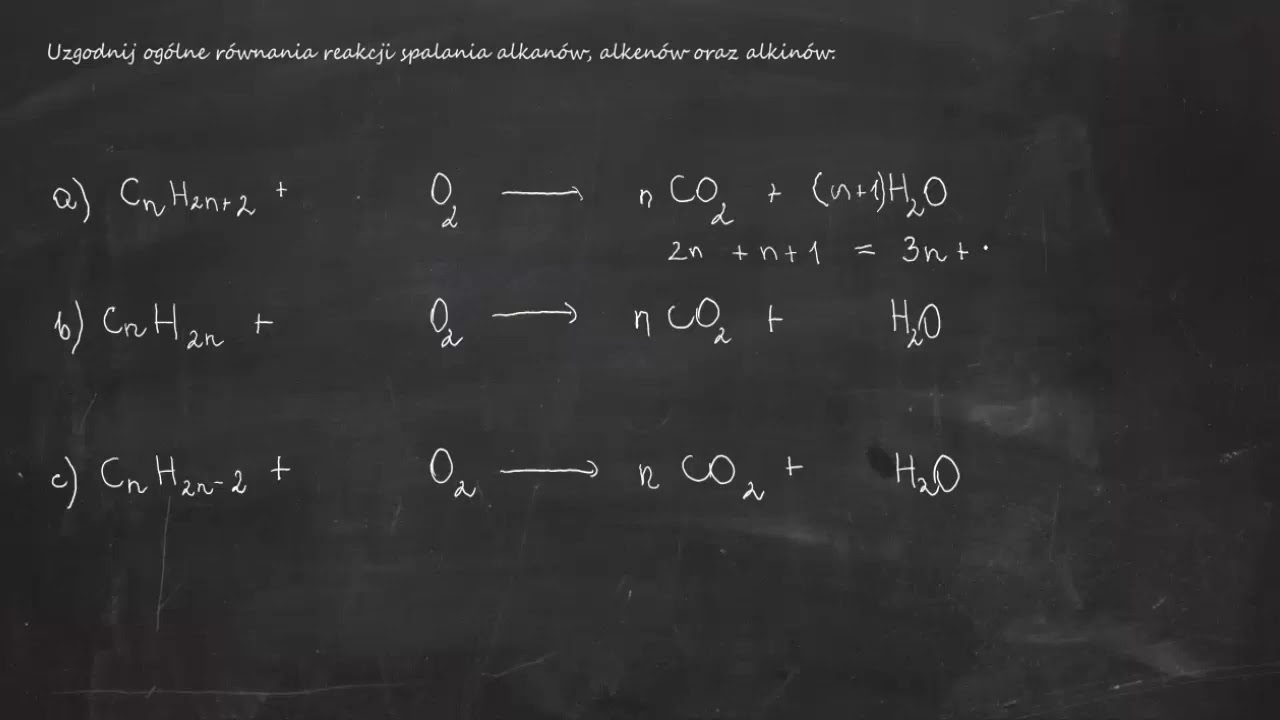Cześć! Chcesz zrozumieć, jak uzupełniać równania reakcji spalania węglowodorów? Świetnie trafiłeś! Przygotuj się na prosty i zrozumiały przewodnik.
Czym są węglowodory?
Zacznijmy od podstaw. Węglowodory to związki chemiczne, które składają się wyłącznie z dwóch pierwiastków: węgla (C) i wodoru (H). Są one fundamentalne dla chemii organicznej i stanowią główny składnik paliw, których używamy na co dzień.
Przykłady? Metan (CH4), który jest głównym składnikiem gazu ziemnego, którym ogrzewamy domy. Propan (C3H8), który znajdziemy w butlach gazowych używanych do grillowania. Albo benzyna, która jest mieszaniną różnych węglowodorów, napędzającą samochody.
Co to jest spalanie?
Spalanie to reakcja chemiczna, w której substancja gwałtownie reaguje z tlenem (O2), wydzielając przy tym ciepło i światło. Mówiąc prościej, to proces, który zachodzi, gdy coś palimy. Drewno w kominku, gaz w kuchence, benzyna w silniku – to wszystko przykłady spalania.
Spalanie jest reakcją egzotermiczną, co oznacza, że uwalnia energię w postaci ciepła. Dlatego przy ognisku jest nam ciepło! W chemii rozróżniamy różne rodzaje spalania, w zależności od tego, jak dużo tlenu jest dostępne. O tym za chwilę.
Równania reakcji chemicznych
Równanie reakcji chemicznej to zapis, który pokazuje, jakie substancje (substraty) reagują ze sobą i jakie substancje (produkty) powstają w wyniku tej reakcji. Na przykład, równanie reakcji powstawania wody z wodoru i tlenu wygląda tak: 2H2 + O2 → 2H2O.
Strzałka (→) oznacza kierunek reakcji, czyli "przechodzi w". Liczby przed symbolami pierwiastków i związków (np. 2H2) nazywamy współczynnikami stechiometrycznymi. Mówią one, w jakich proporcjach molowych substraty reagują ze sobą, a produkty powstają. Ważne jest, aby równanie reakcji było zbilansowane, co oznacza, że liczba atomów każdego pierwiastka po stronie substratów musi być równa liczbie atomów tego samego pierwiastka po stronie produktów.
Rodzaje spalania węglowodorów
W przypadku węglowodorów, spalanie może być całkowite lub niecałkowite, w zależności od ilości dostępnego tlenu.
Spalanie całkowite
Spalanie całkowite zachodzi wtedy, gdy jest wystarczająco dużo tlenu. Produktami spalania całkowitego węglowodorów są dwutlenek węgla (CO2) i woda (H2O). To "idealne" spalanie, w którym cały węgiel przekształca się w dwutlenek węgla.
Ogólny wzór na spalanie całkowite węglowodoru wygląda tak: CxHy + O2 → CO2 + H2O (oczywiście, trzeba dobrać odpowiednie współczynniki).
Spalanie niecałkowite
Spalanie niecałkowite zachodzi, gdy brakuje tlenu. Wtedy, oprócz dwutlenku węgla i wody, mogą powstawać również inne produkty, takie jak: tlenek węgla (CO) (bardzo toksyczny!), węgiel (C) (sadza) oraz woda (H2O).
Ogólny wzór na spalanie niecałkowite jest bardziej skomplikowany, bo produkty mogą być różne: CxHy + O2 → CO2 + H2O + CO + C (znowu, trzeba dobrać odpowiednie współczynniki).
Uzupełnianie równań reakcji spalania – krok po kroku
Teraz najważniejsze – jak uzupełnić równanie reakcji spalania węglowodoru? Oto prosty sposób:
- Zapisz substraty: Po lewej stronie równania wpisz wzór węglowodoru, który spalasz (CxHy) i tlen (O2).
- Zapisz produkty: Po prawej stronie równania wpisz produkty spalania. Jeśli zakładasz spalanie całkowite, to będą to CO2 i H2O. Jeśli niecałkowite, to możesz dodać CO i C.
- Zbilansuj równanie: To najważniejszy krok. Musisz dobrać współczynniki stechiometryczne tak, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
Przykład 1: Spalanie całkowite metanu (CH4)
Zaczynamy od zapisu substratów i produktów: CH4 + O2 → CO2 + H2O
Teraz bilansujemy:
- Węgiel (C): Po lewej stronie mamy 1 atom węgla, po prawej też 1. Ok.
- Wodór (H): Po lewej stronie mamy 4 atomy wodoru, po prawej 2. Dlatego przed H2O musimy wpisać 2: CH4 + O2 → CO2 + 2H2O
- Tlen (O): Po lewej stronie mamy 2 atomy tlenu, po prawej 4 (2 z CO2 i 2 z 2H2O). Dlatego przed O2 musimy wpisać 2: CH4 + 2O2 → CO2 + 2H2O
Gotowe! Uzupełnione i zbilansowane równanie to: CH4 + 2O2 → CO2 + 2H2O
Przykład 2: Spalanie całkowite propanu (C3H8)
Zapisujemy substraty i produkty: C3H8 + O2 → CO2 + H2O
Bilansujemy:
- Węgiel (C): Po lewej 3, po prawej 1. Wpisujemy 3 przed CO2: C3H8 + O2 → 3CO2 + H2O
- Wodór (H): Po lewej 8, po prawej 2. Wpisujemy 4 przed H2O: C3H8 + O2 → 3CO2 + 4H2O
- Tlen (O): Po lewej 2, po prawej 10 (6 z 3CO2 i 4 z 4H2O). Wpisujemy 5 przed O2: C3H8 + 5O2 → 3CO2 + 4H2O
Uzupełnione i zbilansowane równanie: C3H8 + 5O2 → 3CO2 + 4H2O
Przykład 3: Spalanie niecałkowite etanu (C2H6) z powstaniem tlenku węgla (CO) i wody.
Zapisujemy substraty i produkty: C2H6 + O2 → CO + H2O
Bilansujemy:
- Węgiel (C): Po lewej 2, po prawej 1. Wpisujemy 2 przed CO: C2H6 + O2 → 2CO + H2O
- Wodór (H): Po lewej 6, po prawej 2. Wpisujemy 3 przed H2O: C2H6 + O2 → 2CO + 3H2O
- Tlen (O): Po lewej 2, po prawej 5 (2 z 2CO i 3 z 3H2O). Aby mieć po lewej stronie 5, potrzebujemy 2.5 O2, czyli C2H6 + 2.5O2 → 2CO + 3H2O. Mnożymy wszystko razy 2, aby pozbyć się ułamka: 2C2H6 + 5O2 → 4CO + 6H2O.
Uzupełnione i zbilansowane równanie: 2C2H6 + 5O2 → 4CO + 6H2O
Wskazówki i triki
Bilansowanie równań reakcji może być czasami trudne, ale z praktyką staje się łatwiejsze. Oto kilka wskazówek:
- Zacznij od zbilansowania pierwiastka, który występuje w najmniejszej liczbie związków.
- Jeśli masz do czynienia z ułamkami, pomnóż całe równanie przez odpowiednią liczbę, aby się ich pozbyć.
- Sprawdzaj, czy po każdej zmianie współczynnika równanie nadal jest poprawne.
- Nie bój się próbować różnych kombinacji współczynników!
Pamiętaj, że kluczem do sukcesu jest praktyka. Im więcej równań spróbujesz zbilansować, tym lepiej to zrozumiesz. Powodzenia!