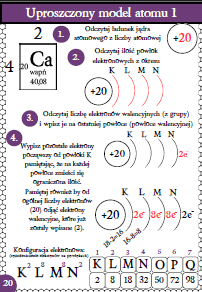
Zrozumienie budowy atomu to podstawa chemii. Atomy są cegiełkami, z których zbudowana jest cała materia. Przyjrzyjmy się uproszczonemu modelowi atomu sodu (Na).
Podstawowe Składniki Atomu
Atomy składają się z trzech podstawowych cząstek: protonów, neutronów i elektronów. Protony i neutrony znajdują się w centralnej części atomu, tworząc jądro atomowe. Elektrony krążą wokół jądra na określonych poziomach energetycznych, zwanych orbitalami lub powłokami elektronowymi.
Protony mają ładunek dodatni (+1). Neutrony są elektrycznie obojętne (ładunek 0). Elektrony mają ładunek ujemny (-1). Liczba protonów w jądrze decyduje o tym, jakim pierwiastkiem jest dany atom. Na przykład, każdy atom sodu ma 11 protonów.
Atom Sodu (Na) - Liczba Atomowa i Masowa
Sód ma symbol chemiczny Na. Jego liczba atomowa wynosi 11. Liczba atomowa to liczba protonów w jądrze atomu. Oznacza to, że każdy atom sodu ma 11 protonów. Liczba masowa to suma liczby protonów i neutronów w jądrze.
Typowy atom sodu ma liczbę masową 23. Oznacza to, że ma 11 protonów i 12 neutronów (23 - 11 = 12). Należy pamiętać, że atomy danego pierwiastka mogą mieć różną liczbę neutronów; nazywamy je izotopami.
Konfiguracja Elektronowa Sodu
Elektrony krążą wokół jądra atomu na określonych poziomach energetycznych. Poziomy te nazywamy powłokami elektronowymi. Powłoki są numerowane: K (1), L (2), M (3), itd. Każda powłoka może pomieścić ograniczoną liczbę elektronów.
Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony. Druga powłoka (L) może pomieścić maksymalnie 8 elektronów. Trzecia powłoka (M) może pomieścić maksymalnie 18 elektronów. Konfiguracja elektronowa sodu to 2, 8, 1.
Oznacza to, że atom sodu ma 2 elektrony na powłoce K, 8 elektronów na powłoce L i 1 elektron na powłoce M. Elektron na ostatniej powłoce (powłoce M w przypadku sodu) nazywany jest elektronem walencyjnym. Elektrony walencyjne odgrywają kluczową rolę w reakcjach chemicznych.
Stabilność Atomów i Reguła Oktetu
Atomy dążą do uzyskania stabilnej konfiguracji elektronowej. Atomy są najbardziej stabilne, gdy ich zewnętrzna powłoka jest w pełni zapełniona (z wyjątkiem wodoru i helu, które dążą do 2 elektronów na powłoce K). Tendencja ta nazywana jest regułą oktetu (dążenie do 8 elektronów na zewnętrznej powłoce).
Sód ma jeden elektron walencyjny. Aby osiągnąć stabilną konfigurację, sód łatwo oddaje ten jeden elektron. Oddając elektron, atom sodu staje się jonem dodatnim (kationem) o ładunku +1 (Na+). Jon Na+ ma konfigurację elektronową 2, 8, co jest stabilną konfiguracją neonu.
Tworzenie Związków Chemicznych
Sód jest bardzo reaktywnym metalem. Reaguje z innymi pierwiastkami, tworząc związki chemiczne. Na przykład, sód reaguje z chlorem (Cl), tworząc chlorek sodu (NaCl), czyli sól kuchenną. Chlor ma 7 elektronów walencyjnych i chętnie przyjmuje jeden elektron, aby osiągnąć oktet.
W reakcji z chlorem, atom sodu oddaje swój elektron walencyjny atomowi chloru. Sód staje się jonem Na+, a chlor staje się jonem Cl-. Przeciwne ładunki przyciągają się, tworząc wiązanie jonowe. Powstaje stabilna cząsteczka chlorku sodu (NaCl).
Zastosowania Sodu
Sód i jego związki mają wiele zastosowań. Chlorek sodu (sól kuchenna) jest niezbędny dla życia. Sód jest również stosowany w produkcji różnych chemikaliów, takich jak wodorotlenek sodu (NaOH), używany do produkcji mydła i papieru. Sód w postaci metalicznej jest stosowany w lampach sodowych, które emitują intensywne żółte światło.
Sód występuje również w wielu naturalnych związkach mineralnych. Jest ważnym składnikiem płynów ustrojowych i odgrywa kluczową rolę w przewodzeniu impulsów nerwowych. Badanie budowy atomu sodu i jego właściwości pozwala nam lepiej zrozumieć jego rolę w chemii i biologii.