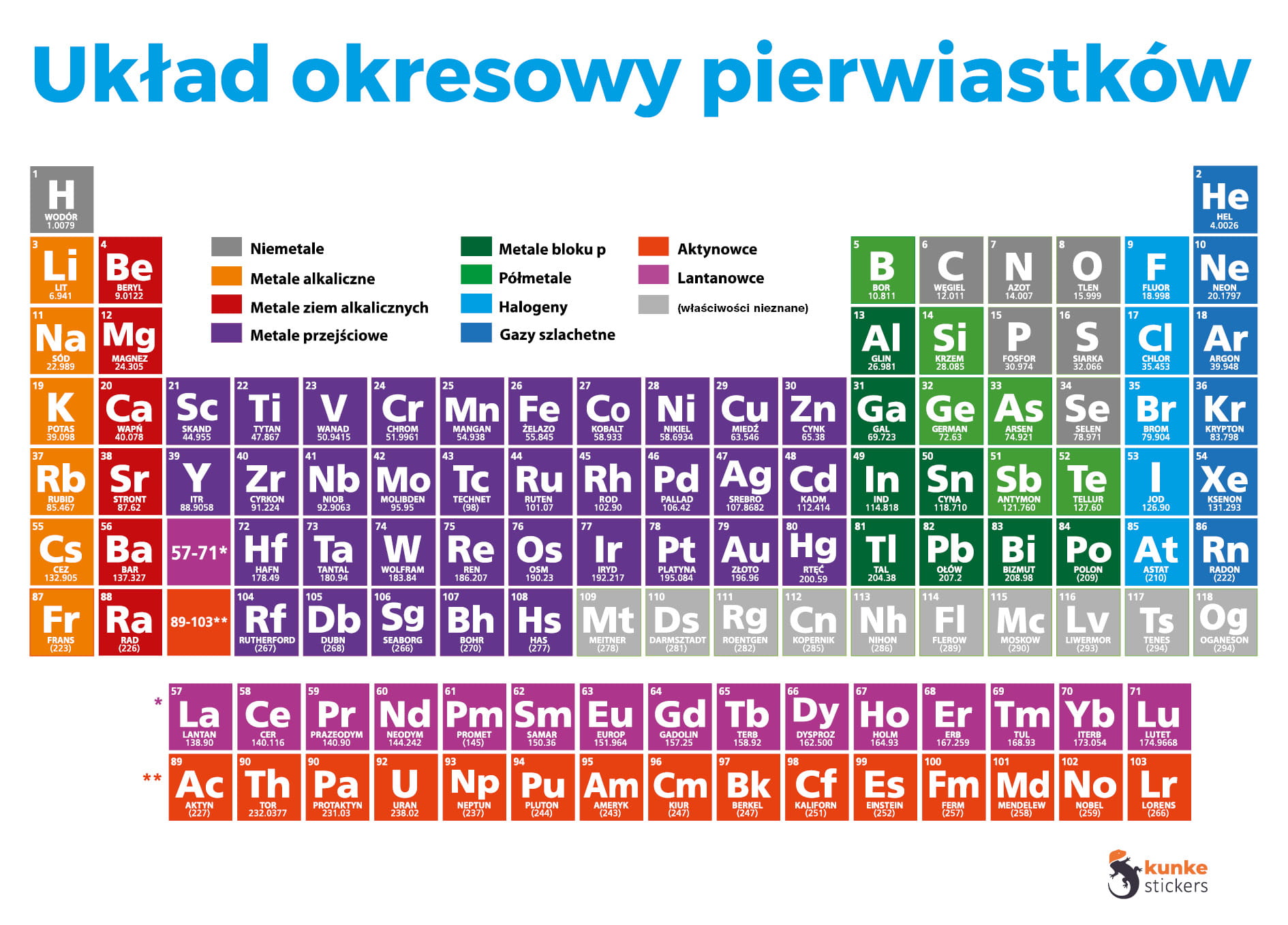
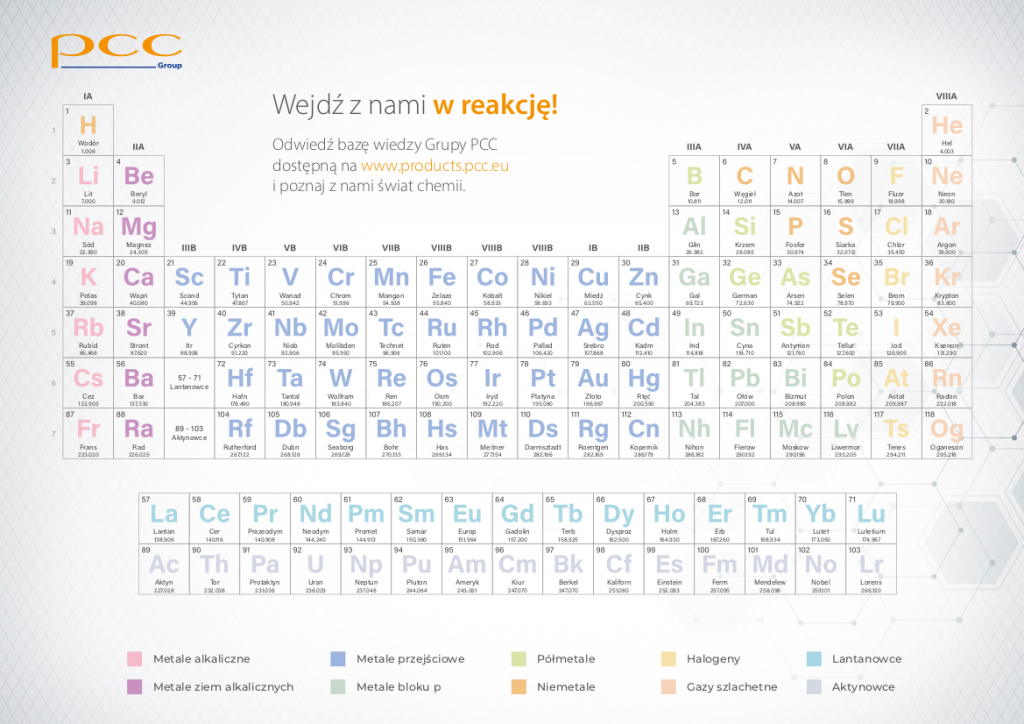
Układ Okresowy Pierwiastków, znany również jako tablica Mendelejewa, to fundamentalne narzędzie w chemii. Prezentuje on wszystkie znane pierwiastki chemiczne w uporządkowany sposób. Organizacja ta opiera się na ich liczbie atomowej i właściwościach chemicznych. Pozwala to łatwo przewidywać zachowanie pierwiastków i związków chemicznych.
Wartościowość pierwiastka to liczba wiązań chemicznych, które atom danego pierwiastka może utworzyć z innymi atomami. Można ją rozumieć jako zdolność atomu do łączenia się z innymi atomami. Wartościowość jest często związana z liczbą elektronów walencyjnych, czyli elektronów znajdujących się na ostatniej powłoce elektronowej atomu. Zrozumienie wartościowości jest kluczowe do przewidywania wzorów chemicznych związków. Znajomość wartościowości ułatwia też pisanie równań reakcji chemicznych.
W Układzie Okresowym wartościowość pierwiastków często powtarza się w grupach. Pierwiastki w tej samej grupie mają zwykle podobną wartościowość. Na przykład, pierwiastki w grupie 1 (litowce) mają wartościowość równą 1. Pierwiastki w grupie 2 (berylowce) mają wartościowość równą 2. Jednak nie wszystkie grupy przestrzegają tej zasady ściśle, szczególnie w przypadku pierwiastków przejściowych.
Okresowość Wartościowości
Wartościowość pierwiastków wykazuje okresowość, co oznacza, że zmienia się w regularny sposób wzdłuż okresów i grup Układu Okresowego. W okresach, wartościowość zwykle wzrasta od lewej do prawej, osiągając maksimum w środku, a następnie maleje. Ta zmienność wynika ze zmian w konfiguracji elektronowej atomów. Zrozumienie okresowości wartościowości pozwala przewidywać właściwości chemiczne pierwiastków.
W grupach, wartościowość zwykle jest stała dla większości pierwiastków, choć istnieją wyjątki. Na przykład, fluor (F), chlor (Cl), brom (Br) i jod (I) (halogeny, grupa 17) mają wartościowość 1. Tlen (O) i siarka (S) (chalkogeny, grupa 16) mają wartościowość 2 (najczęściej). Wyjątki występują szczególnie wśród pierwiastków cięższych i pierwiastków przejściowych.
Wartościowość a Grupa
Związek między wartościowością a numerem grupy jest wyraźny, szczególnie dla pierwiastków grup głównych (grupy 1, 2 i 13-17). Pierwiastki z grupy 1 mają jeden elektron walencyjny i tworzą wiązania z wartościowością 1. Pierwiastki z grupy 2 mają dwa elektrony walencyjne i tworzą wiązania z wartościowością 2. W grupach 13-17, wartościowość można określić odejmując numer grupy od 18. Na przykład, pierwiastki z grupy 16 (18-16 = 2) mają tendencję do tworzenia wiązań z wartościowością 2.
Pierwiastki przejściowe, znajdujące się w środkowej części Układu Okresowego, często wykazują zmienną wartościowość. Oznacza to, że dany pierwiastek może tworzyć związki z różnymi wartościowościami. Przykładem jest żelazo (Fe), które może występować jako Fe2+ (wartościowość 2) lub Fe3+ (wartościowość 3). Zmienna wartościowość wynika z możliwości wykorzystania elektronów z różnych powłok elektronowych do tworzenia wiązań.
Przykłady i Zastosowania
Przykłady związków chemicznych ilustrują znaczenie wartościowości. W wodzie (H2O) tlen (O) ma wartościowość 2, a wodór (H) ma wartościowość 1. Dwa atomy wodoru łączą się z jednym atomem tlenu, aby spełnić wymagania wartościowości. W dwutlenku węgla (CO2) węgiel (C) ma wartościowość 4, a tlen (O) ma wartościowość 2. Jeden atom węgla łączy się z dwoma atomami tlenu.
Znajomość wartościowości jest kluczowa w wielu dziedzinach chemii. Pozwala na przewidywanie wzorów związków chemicznych. Umożliwia pisanie i bilansowanie równań reakcji chemicznych. Jest niezbędna w analizie chemicznej i syntezie związków. W przemyśle chemicznym, znajomość wartościowości jest ważna w projektowaniu procesów produkcyjnych i optymalizacji reakcji.
Jak Korzystać z Układu Okresowego z Wartościowością (PDF)
Układ Okresowy z Wartościowością w formacie PDF jest cennym narzędziem edukacyjnym. Zazwyczaj zawiera informacje o wartościowościach poszczególnych pierwiastków. Korzystając z takiego Układu Okresowego, należy zwrócić uwagę na wartościowość podaną dla każdego pierwiastka. W przypadku pierwiastków o zmiennej wartościowości, mogą być podane różne możliwe wartości. Należy również pamiętać, że niektóre pierwiastki mogą wykazywać nietypowe wartościowości w specyficznych związkach.
Podsumowując, Układ Okresowy Pierwiastków to podstawa chemii. Rozumienie wartościowości i jej związku z położeniem pierwiastka w Układzie Okresowym jest kluczowe. Pozwala to na przewidywanie właściwości i zachowań pierwiastków. Ułatwia to zrozumienie budowy związków chemicznych. Znajomość wartościowości jest niezbędna dla każdego, kto zajmuje się chemią, zarówno w edukacji, jak i w praktyce.