Witajcie przyszli maturzyści! Czeka Was egzamin z chemii? Super! Razem przejdziemy przez tlenki, wodorotlenki, kwasy i sole. Będziecie czuć się pewnie rozwiązując zadania maturalne.
Tlenki
Zaczynamy od tlenków. To związki chemiczne tlenu z innym pierwiastkiem. Pamiętajcie o ogólnym wzorze: ExOy, gdzie E to symbol pierwiastka.
Nazewnictwo Tlenków
Jak nazywamy tlenki? Nazwa składa się z "tlenek" + nazwa pierwiastka + wartościowość (jeśli pierwiastek ma zmienną wartościowość). Przykłady?
- Na2O – tlenek sodu
- Fe2O3 – tlenek żelaza(III)
- CO2 – tlenek węgla(IV)
Rodzaje Tlenków
Istnieją różne rodzaje tlenków, ważne do rozróżnienia:
- Tlenki zasadowe – reagują z kwasami, tworząc sole. Typowe dla metali. Przykład: Na2O.
- Tlenki kwasowe (bezwodniki kwasowe) – reagują z zasadami, tworząc sole. Typowe dla niemetali. Przykład: SO2.
- Tlenki amfoteryczne – reagują zarówno z kwasami, jak i zasadami. Przykład: ZnO.
- Tlenki obojętne – nie reagują ani z kwasami, ani z zasadami. Przykład: CO.
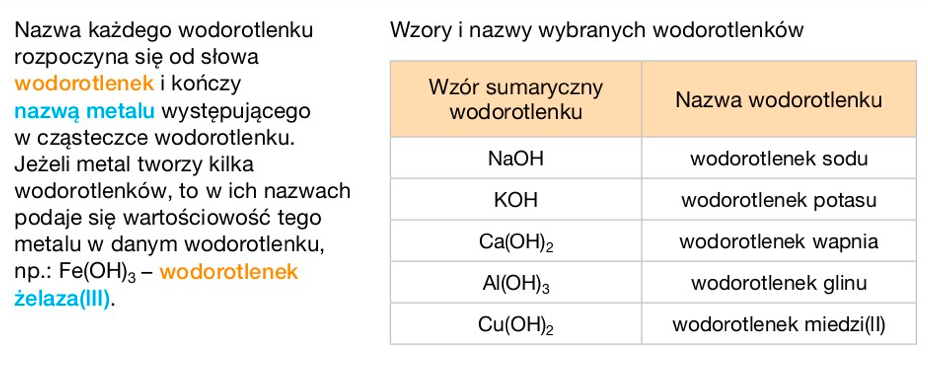
Wodorotlenki
Teraz czas na wodorotlenki! To związki zawierające grupę OH- połączoną z metalem. Ogólny wzór to M(OH)n, gdzie M to metal, a n to jego wartościowość.
Nazewnictwo Wodorotlenków
Nazywamy je: "wodorotlenek" + nazwa metalu + wartościowość (jeśli metal ma zmienną wartościowość).
- NaOH – wodorotlenek sodu
- Ca(OH)2 – wodorotlenek wapnia
- Fe(OH)3 – wodorotlenek żelaza(III)
Właściwości Wodorotlenków
Wodorotlenki metali grup 1 i 2 (z wyjątkiem berylu i magnezu) są mocnymi zasadami. Rozpuszczają się w wodzie, tworząc roztwory o odczynie zasadowym. Roztwory te nazywamy ługami.
Kwasy
Przechodzimy do kwasów. To związki, które w roztworach wodnych dysocjują na kationy wodoru (H+) i aniony reszty kwasowej.
Rodzaje Kwasów
Mamy kwasy tlenowe i beztlenowe.
- Kwasy beztlenowe – np. HCl (kwas chlorowodorowy), H2S (kwas siarkowodorowy).
- Kwasy tlenowe – np. H2SO4 (kwas siarkowy(VI)), HNO3 (kwas azotowy(V)), H3PO4 (kwas fosforowy(V)).
Nazewnictwo Kwasów
Kwasy beztlenowe: "kwas" + nazwa niemetalu + "wodorowy". Kwasy tlenowe: "kwas" + nazwa niemetalu + końcówka wynikająca z wartościowości (np. -owy, -awy).
Właściwości Kwasów
Kwasy mają odczyn kwaśny. Reagują z metalami (nie wszystkimi!), zasadami i tlenkami zasadowymi, tworząc sole. Powodują zmiany barwy wskaźników (np. oranż metylowy na czerwono, lakmus na czerwono).
Sole
Na koniec – sole! To związki, które powstają w wyniku reakcji kwasu z zasadą (reakcja zobojętniania), kwasu z metalem, kwasu z tlenkiem metalu lub zasady z tlenkiem niemetalu. Zawierają kation metalu (lub amonu NH4+) i anion reszty kwasowej.
Nazewnictwo Soli
Nazwa soli: nazwa anionu reszty kwasowej + nazwa kationu metalu + wartościowość (jeśli metal ma zmienną wartościowość).
- NaCl – chlorek sodu
- CaCO3 – węglan wapnia
- FeSO4 – siarczan(VI) żelaza(II)
Rodzaje Soli
Ważne jest rozróżnienie soli obojętnych, kwaśnych i zasadowych.
- Sole obojętne – pochodzą od całkowitego zastąpienia atomów wodoru w kwasie przez metal.
- Sole kwaśne (wodorosole) – pochodzą od niecałkowitego zastąpienia atomów wodoru w kwasie przez metal (zawierają H w anionie). Przykład: NaHCO3.
- Sole zasadowe (hydroksosole) – zawierają grupę OH w kationie.
Zadania Maturalne
Ok, teoria za nami! Teraz najważniejsze – zadania maturalne. Jak je rozwiązywać?
- Czytaj uważnie treść zadania. Zwróć uwagę na wszystkie informacje i polecenia.
- Zapisz reakcje chemiczne. Upewnij się, że są dobrze zbilansowane.
- Wykorzystaj wiedzę o nazewnictwie. Poprawne nazwanie związku to podstawa.
- Pamiętaj o właściwościach. Wiedza o reakcjach tlenków, wodorotlenków, kwasów i soli jest kluczowa.
- Przeanalizuj typowe zadania. Rozwiązuj zadania z poprzednich lat.
Przykładowe zadanie:
Zadanie: Napisz równanie reakcji tlenku siarki(IV) z wodorotlenkiem potasu. Nazwij produkty reakcji.
Rozwiązanie:
SO2 + 2KOH → K2SO3 + H2O
Produktami są: siarczan(IV) potasu i woda.
Podsumowanie
Pamiętajcie! Kluczem do sukcesu jest:
- Znajomość nazewnictwa i wzorów tlenków, wodorotlenków, kwasów i soli.
- Zrozumienie ich właściwości i reakcji.
- Ćwiczenie rozwiązywania zadań.
Powodzenia na maturze! Wierzę w Was!