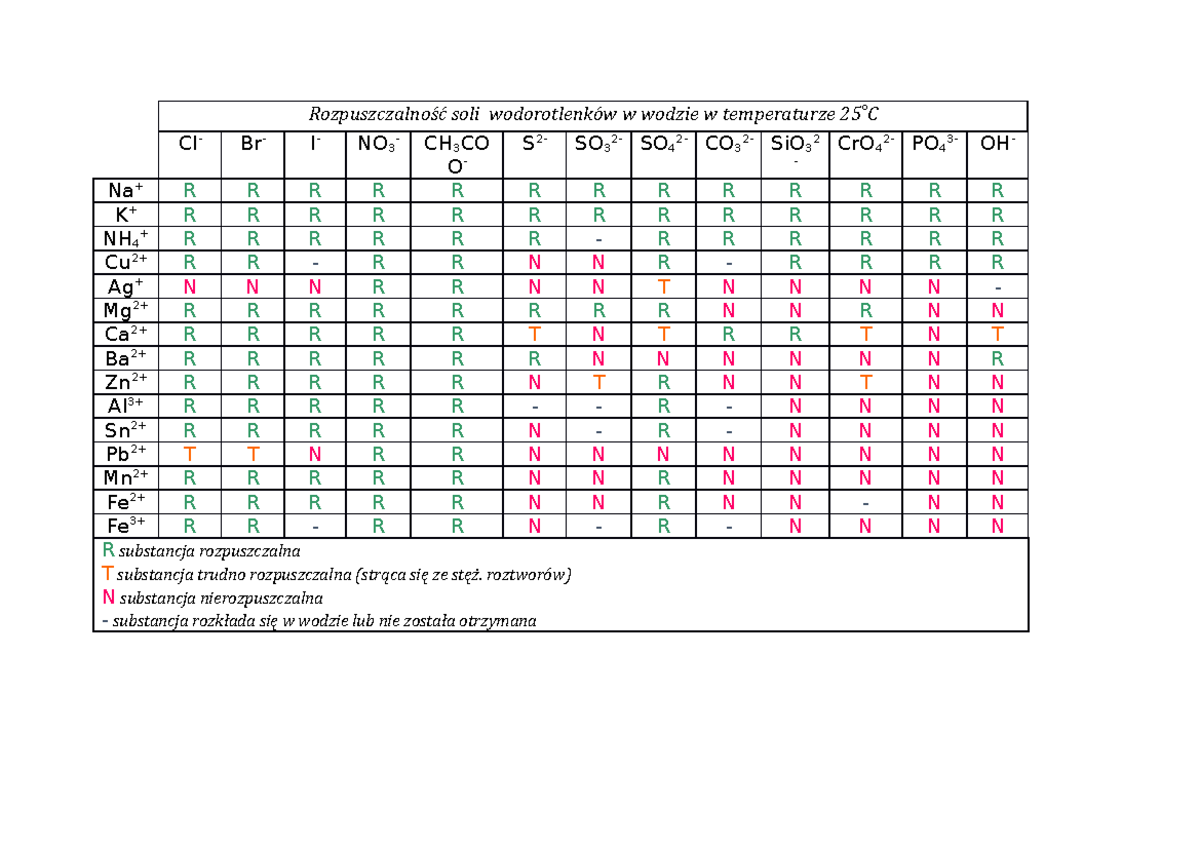
Witajcie, drodzy studenci! Dzisiaj zagłębimy się w fascynujący świat chemii, a konkretnie w tabelę rozpuszczalności wodorotlenków w wodzie. To narzędzie, które ułatwia przewidywanie, czy dany wodorotlenek rozpuści się w wodzie, tworząc roztwór, czy też pozostanie w formie osadu. Zrozumienie tej tabeli jest kluczowe w wielu dziedzinach chemii.
Zacznijmy od podstaw. Czym tak właściwie jest rozpuszczalność? Najprościej mówiąc, to zdolność substancji (np. wodorotlenku) do rozpuszczania się w rozpuszczalniku (w naszym przypadku w wodzie). Kiedy substancja się rozpuszcza, jej cząsteczki rozpraszają się równomiernie w rozpuszczalniku, tworząc jednorodną mieszaninę, czyli roztwór.
Wodorotlenki - co to takiego?
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (OH-) połączoną z metalem. Ogólny wzór wodorotlenku to Me(OH)n, gdzie Me to metal, a n to jego wartościowość. Przykłady wodorotlenków to wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH) i wodorotlenek wapnia (Ca(OH)2). Wodorotlenki są zazwyczaj ciałami stałymi o budowie jonowej. Wiele z nich ma charakter zasadowy.
Właściwości wodorotlenków są zróżnicowane. Niektóre z nich, takie jak wodorotlenek sodu (NaOH), są bardzo dobrze rozpuszczalne w wodzie i tworzą silne zasady. Inne, na przykład wodorotlenek żelaza(III) (Fe(OH)3), są praktycznie nierozpuszczalne i tworzą osady. To właśnie dlatego potrzebujemy tabeli rozpuszczalności, aby móc przewidzieć, jak zachowa się dany wodorotlenek w wodzie.
Jak czytać tabelę rozpuszczalności?
Tabela rozpuszczalności to swego rodzaju mapa drogowa, która pomaga nam określić rozpuszczalność różnych związków, w tym wodorotlenków, w wodzie. Zazwyczaj w tabeli znajdziemy listę kationów (jonów dodatnich, np. Na+, K+, Ca2+) w jednej kolumnie i anionów (jonów ujemnych, w tym OH-) w innym wierszu. W miejscu, gdzie krzyżuje się dany kation i anion, znajdziemy informację o rozpuszczalności związku, który tworzą.
Symbole używane w tabeli rozpuszczalności:
- R lub "rozp." oznacza, że związek jest rozpuszczalny w wodzie.
- N lub "nier." oznacza, że związek jest nierozpuszczalny w wodzie (lub rozpuszcza się w bardzo małym stopniu). Zazwyczaj tworzy osad.
- S lub "słabo rozp." oznacza, że związek jest słabo rozpuszczalny w wodzie. Oznacza to, że tylko niewielka ilość związku rozpuści się w wodzie.
Warto pamiętać, że "nierozpuszczalny" nie oznacza absolutnego braku rozpuszczalności. Zawsze istnieje pewien minimalny stopień rozpuszczalności, ale dla praktycznych celów, uznajemy, że związek jest nierozpuszczalny, jeśli ta rozpuszczalność jest bardzo niska.
Przykłady zastosowania tabeli rozpuszczalności
Spójrzmy na kilka przykładów, jak korzystać z tabeli rozpuszczalności dla wodorotlenków: * Wodorotlenek sodu (NaOH): W tabeli rozpuszczalności, wodorotlenki metali alkalicznych (grupa 1 układu okresowego, do której należy sód) zazwyczaj są rozpuszczalne. Zatem NaOH jest rozpuszczalny w wodzie i tworzy silny roztwór zasadowy. * Wodorotlenek wapnia (Ca(OH)2): Wodorotlenek wapnia jest słabo rozpuszczalny. Oznacza to, że tylko niewielka ilość Ca(OH)2 rozpuści się w wodzie, tworząc tzw. wodę wapienną. Większość wodorotlenku pozostanie w postaci osadu. * Wodorotlenek żelaza(III) (Fe(OH)3): Wodorotlenki metali przejściowych (do których należy żelazo) zazwyczaj są nierozpuszczalne. Zatem Fe(OH)3 jest nierozpuszczalny i tworzy osad o rdzawym kolorze. Te przykłady ilustrują, jak tabela rozpuszczalności pozwala nam przewidzieć, co się stanie, gdy dodamy dany wodorotlenek do wody.
Wyjątki potwierdzają regułę
Warto pamiętać, że tabela rozpuszczalności to tylko uogólnienie. Istnieją wyjątki od reguł, które warto zapamiętać. Na przykład, wodorotlenki metali alkalicznych (lit, sód, potas, rubid, cez) są generalnie rozpuszczalne, ale rozpuszczalność wodorotlenku litu (LiOH) jest niższa niż pozostałych. Również rozpuszczalność niektórych wodorotlenków może zależeć od temperatury. Im wyższa temperatura, tym rozpuszczalność może być większa.
Kolejnym ważnym aspektem jest efekt wspólnego jonu. Jeśli do roztworu zawierającego dany wodorotlenek dodamy substancję, która zawiera wspólny jon (np. OH-), rozpuszczalność wodorotlenku może się zmniejszyć. To zjawisko jest zgodne z prawem działania mas.
Znaczenie w życiu codziennym i w laboratorium
Zrozumienie rozpuszczalności wodorotlenków ma wiele praktycznych zastosowań. Na przykład, w oczyszczalniach ścieków wodorotlenek wapnia (wapno gaszone) jest używany do strącania zanieczyszczeń, tworząc osady, które można łatwo usunąć. W laboratorium, znajomość rozpuszczalności jest kluczowa przy przeprowadzaniu reakcji chemicznych i analizach jakościowych.
Wyobraźmy sobie sytuację, w której chcemy zneutralizować kwas solny (HCl) w laboratorium. Możemy użyć wodorotlenku sodu (NaOH), który jest dobrze rozpuszczalny i łatwo reaguje z kwasem. Jednakże, jeśli chcielibyśmy użyć wodorotlenku żelaza(III) (Fe(OH)3), który jest nierozpuszczalny, reakcja byłaby znacznie wolniejsza i mniej efektywna. Dlatego też, znajomość rozpuszczalności pomaga nam wybrać odpowiednie odczynniki chemiczne.
Podsumowanie
Tabela rozpuszczalności wodorotlenków w wodzie to cenne narzędzie, które pozwala przewidywać, czy dany wodorotlenek rozpuści się w wodzie, czy też utworzy osad. Pamiętajcie, że rozpuszczalność zależy od rodzaju metalu połączonego z grupą hydroksylową, a także od warunków zewnętrznych, takich jak temperatura. Znajomość tej tabeli jest niezbędna dla każdego studenta chemii, a także przydatna w wielu dziedzinach życia codziennego. Życzę powodzenia w dalszej nauce chemii!