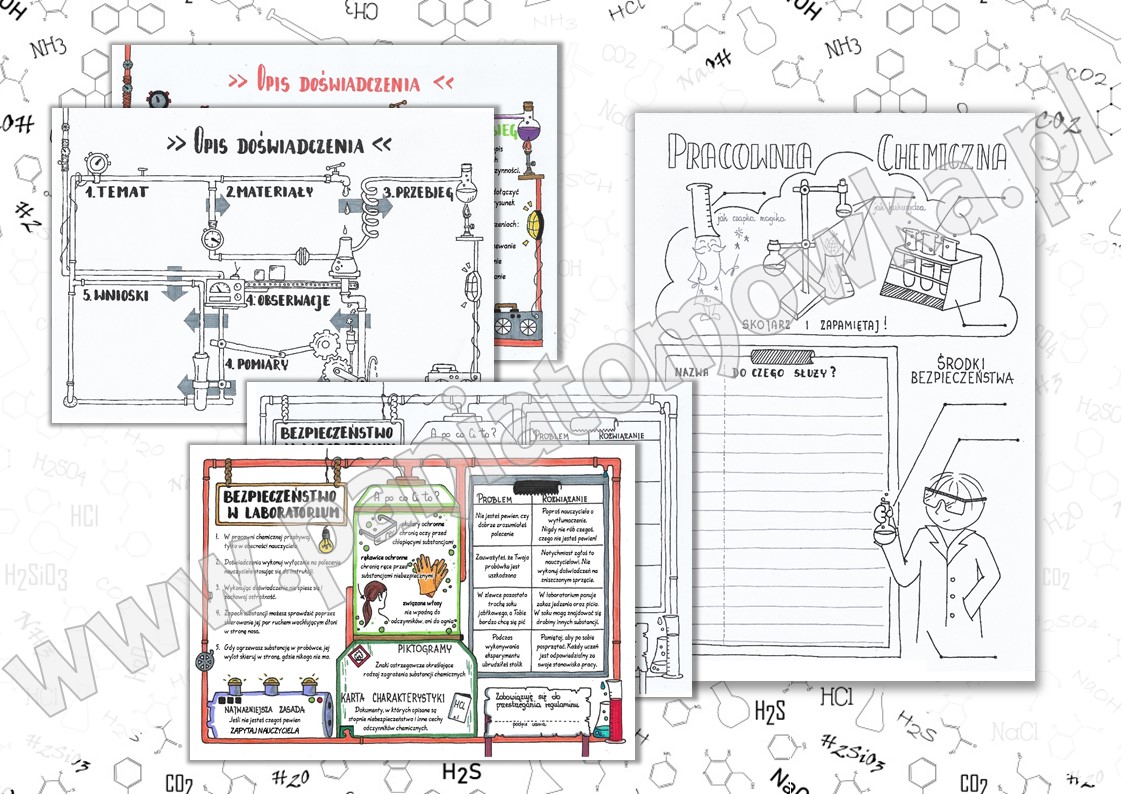
Substancje i ich przemiany – to temat sprawdzianu z chemii dla klasy 7. Spokojnie! Zaraz wszystko wytłumaczymy krok po kroku.
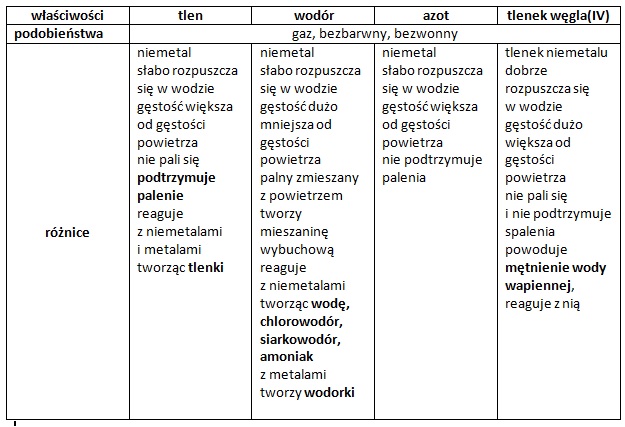
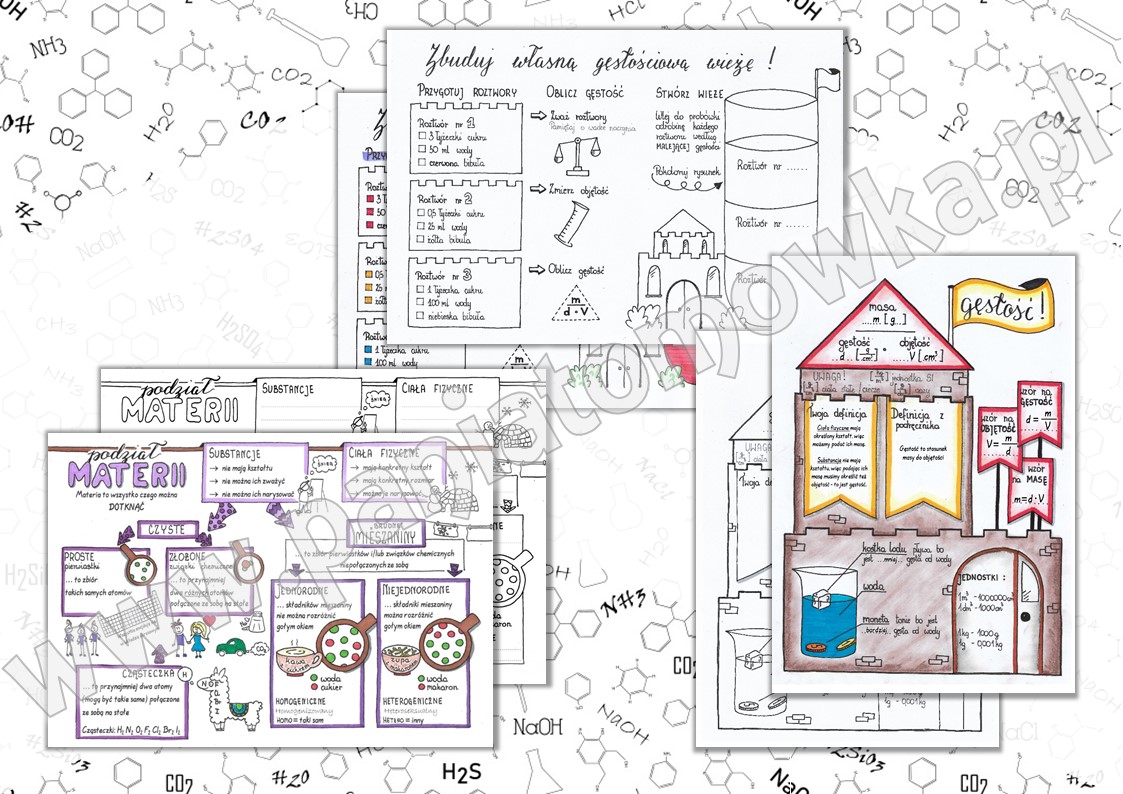
Czym są substancje? To po prostu wszystko, co nas otacza i ma masę. Przykłady: woda (H2O), sól (NaCl), cukier (C12H22O11), powietrze (mieszanina gazów).
Substancje dzielimy na pierwiastki i związki chemiczne. Pierwiastki to podstawowe cegiełki, np. tlen (O), wodór (H), żelazo (Fe). Związki chemiczne to połączenia różnych pierwiastków, np. woda (H2O) – połączenie wodoru i tlenu.
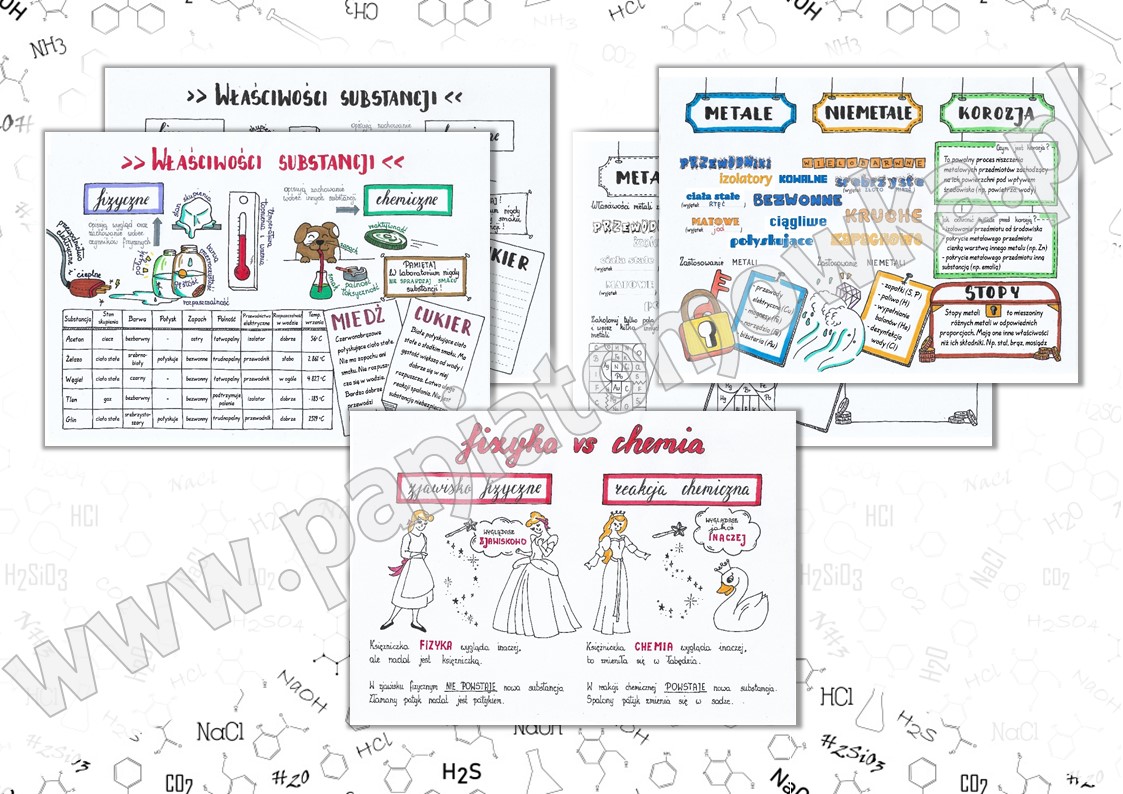
Przemiany substancji to zmiany, które w nich zachodzą. Mamy dwa główne rodzaje przemian: fizyczne i chemiczne.
Przemiana fizyczna: zmienia się wygląd, ale nie skład substancji. Przykład: woda zmienia się w lód (zamrażanie) lub parę wodną (wrzenie). Nadal jest to woda (H2O)! Inny przykład: rozpuszczanie cukru w wodzie. Nadal mamy cukier i wodę, tylko wymieszane.
Przemiana chemiczna (reakcja chemiczna): powstają nowe substancje o innych właściwościach! Przykład: spalanie drewna. Drewno zamienia się w popiół, dym i gazy. Powstały zupełnie nowe substancje. Inny przykład: rdzewienie żelaza. Żelazo (Fe) reaguje z tlenem (O2) z powietrza, tworząc rdzę (tlenek żelaza) - nową substancję.
Jak odróżnić? Przemiany fizyczne są często odwracalne (np. możemy ponownie zamrozić wodę), a chemiczne – zazwyczaj nie (nie zmienimy popiołu z powrotem w drewno).
Pamiętaj o obserwacjach! Podczas reakcji chemicznych często obserwujemy: zmianę koloru, wydzielanie gazu (bąbelki!), powstawanie osadu (coś się wytrąca z roztworu) lub zmianę temperatury (ogrzewanie lub chłodzenie).
Powodzenia na sprawdzianie! Skup się na zrozumieniu różnicy między przemianami fizycznymi a chemicznymi i obserwuj świat wokół siebie!