Hej ósmoklasisto! Przygotowujesz się do sprawdzianu z soli? Super! Razem damy radę!
Czym są sole?
Sole to związki chemiczne. Powstają, gdy kwas reaguje z zasadą lub metalem.
Możemy je też uzyskać z reakcji tlenku kwasowego z tlenkiem zasadowym.
Budowa soli
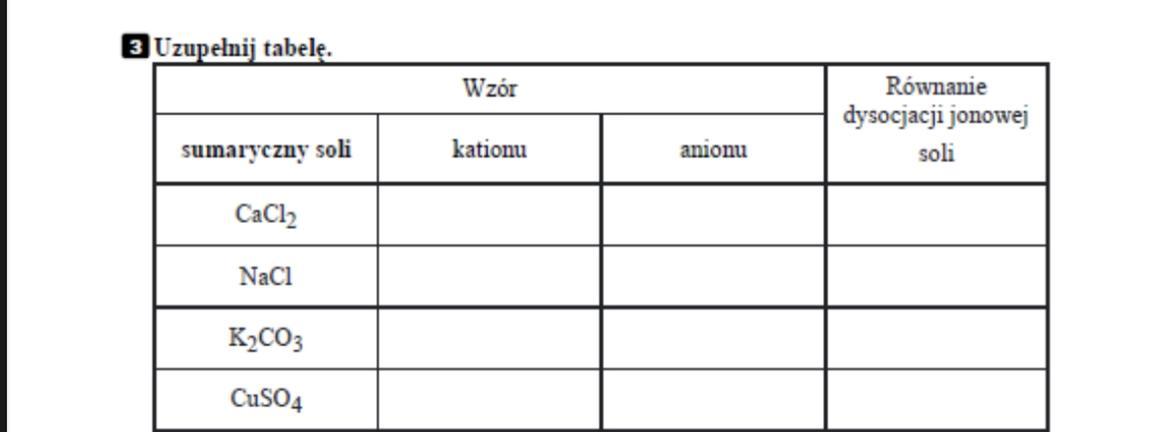
Sole składają się z kationu metalu (lub kationu amonu NH4+) oraz anionu reszty kwasowej.
Na przykład, w chlorku sodu (NaCl), kationem jest Na+, a anionem Cl-.
Nazewnictwo soli
Nazwa soli składa się z dwóch części.
Pierwsza część to nazwa anionu reszty kwasowej, np. chlorek, siarczan(VI), azotan(V).
Druga część to nazwa kationu metalu, np. sodu, potasu, żelaza(II).
Jeśli metal tworzy kilka jonów, podajemy jego wartościowość w nawiasie, np. żelaza(II), żelaza(III).
Przykłady: chlorek sodu (NaCl), siarczan(VI) potasu (K2SO4), azotan(V) żelaza(III) (Fe(NO3)3).
Wzory sumaryczne soli
Układając wzór soli, pamiętaj o równoważeniu wartościowości kationu i anionu.
Przykład: żelazo(III) (Fe3+) i siarczan(VI) (SO42-).
Aby wartościowości się zrównały, potrzebujemy 2 jony żelaza(III) i 3 jony siarczan(VI). Wzór to Fe2(SO4)3.
Inny przykład: wapń (Ca2+) i fosforan(V) (PO43-).
Aby wartościowości się zrównały, potrzebujemy 3 jony wapnia i 2 jony fosforan(V). Wzór to Ca3(PO4)2.
Otrzymywanie soli
Sole można otrzymać na wiele sposobów.
1. Reakcja kwasu z zasadą (reakcja zobojętniania):
kwas + zasada → sól + woda
Przykład: HCl + NaOH → NaCl + H2O
2. Reakcja metalu z kwasem:
metal + kwas → sól + wodór
Przykład: Zn + H2SO4 → ZnSO4 + H2
3. Reakcja tlenku metalu z kwasem:
tlenek metalu + kwas → sól + woda
Przykład: CuO + 2HCl → CuCl2 + H2O
4. Reakcja metalu z niemetalem:
metal + niemetal → sól
Przykład: 2Na + Cl2 → 2NaCl
5. Reakcja tlenku kwasowego z tlenkiem zasadowym:
tlenek kwasowy + tlenek zasadowy → sól
Przykład: CaO + SO3 → CaSO4
6. Reakcja soli z kwasem (sól musi być nierozpuszczalna, a powstający kwas słabszy):
sól1 + kwas → sól2 + kwas2
Przykład: CaCO3 + 2HCl → CaCl2 + H2CO3 (H2CO3 rozkłada się na H2O + CO2)
7. Reakcja soli z zasadą (sól musi być rozpuszczalna, a powstająca zasada nierozpuszczalna):
sól1 + zasada → sól2 + zasada2
Przykład: CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
8. Reakcja soli z solą (obie sole muszą być rozpuszczalne, a powstająca sól nierozpuszczalna):
sól1 + sól2 → sól3↓ + sól4
Przykład: AgNO3 + NaCl → AgCl↓ + NaNO3
Właściwości soli
Sole mają różne właściwości. Zależą one od rodzaju kationu i anionu.
Wiele soli jest rozpuszczalnych w wodzie. Możesz to sprawdzić w tabeli rozpuszczalności soli.
Niektóre sole są higroskopijne, czyli pochłaniają wilgoć z otoczenia.
Sole mogą mieć różne barwy, np. chlorek miedzi(II) jest zielony, siarczan(VI) miedzi(II) jest niebieski.
Zastosowanie soli
Sole mają szerokie zastosowanie.
Chlorek sodu (NaCl), czyli sól kuchenna, jest używany w kuchni do przyprawiania potraw i konserwacji żywności.
Węglan sodu (Na2CO3), czyli soda kalcynowana, jest używany w przemyśle szklarskim, papierniczym i chemicznym.
Siarczan(VI) wapnia (CaSO4), czyli gips, jest używany w budownictwie i medycynie.
Azotan(V) potasu (KNO3), czyli saletra potasowa, jest używany jako nawóz.
Reakcje charakterystyczne
Naucz się rozpoznawać charakterystyczne reakcje dla poszczególnych anionów.
Na przykład, wykrywanie chlorków (Cl-) polega na dodaniu roztworu azotanu(V) srebra (AgNO3). Powstaje biały, serowaty osad chlorku srebra (AgCl), który ciemnieje pod wpływem światła.
AgNO3 + Cl- → AgCl↓ + NO3-
Wykrywanie siarczanów(VI) (SO42-) polega na dodaniu roztworu chlorku baru (BaCl2). Powstaje biały osad siarczanu(VI) baru (BaSO4), nierozpuszczalny w kwasach.
BaCl2 + SO42- → BaSO4↓ + 2Cl-
Podsumowanie
Pamiętaj, że:
- Sole składają się z kationu metalu (lub kationu amonu) i anionu reszty kwasowej.
- Nazwy soli tworzymy od nazwy anionu reszty kwasowej i nazwy kationu metalu.
- Sole można otrzymać na wiele sposobów, np. w reakcji kwasu z zasadą, metalu z kwasem.
- Sole mają różne właściwości i zastosowania.
Powodzenia na sprawdzianie! Wierzę w Ciebie!