Chemia w ósmej klasie to czas, gdy poznajemy wiele nowych i fascynujących zagadnień. Jednym z nich są kwasy. Zrozumienie ich właściwości jest kluczowe. To podstawa do dalszej nauki.
Co to są kwasy?
Kwasy to związki chemiczne. Mają charakterystyczne właściwości. Zawierają atomy wodoru, które mogą oddawać podczas reakcji chemicznych. To właśnie te atomy wodoru decydują o kwaśnym odczynie.
Definicja kwasu według Arrheniusa mówi, że to substancja, która w roztworze wodnym dysocjuje na jony wodorowe (H+). Przykładem jest kwas chlorowodorowy (HCl). Po rozpuszczeniu w wodzie tworzy jony H+ i Cl-.
Warto zapamiętać, że kwasy mają kwaśny smak. Należy jednak pamiętać, że smakowanie kwasów w laboratorium jest bardzo niebezpieczne. Może spowodować poważne poparzenia. Nigdy nie próbuj kwasów!
Właściwości kwasów
Kwasy posiadają szereg charakterystycznych właściwości. Zmieniają barwę wskaźników. Na przykład lakmus zmienia kolor na czerwony. Oranż metylowy również staje się czerwony w obecności kwasów. Fenoloftaleina pozostaje bezbarwna.
Kwasy reagują z metalami. W wyniku reakcji powstaje sól i wodór. Przykład: kwas solny (HCl) reaguje z cynkiem (Zn), tworząc chlorek cynku (ZnCl2) i wodór (H2). Reakcja ta jest często wykorzystywana w laboratoriach do produkcji wodoru.
Reakcja kwasów z zasadami nazywana jest reakcją zobojętniania. W wyniku reakcji powstaje sól i woda. Przykład: kwas solny (HCl) reaguje z wodorotlenkiem sodu (NaOH), tworząc chlorek sodu (NaCl) i wodę (H2O). Reakcja ta jest egzotermiczna, co oznacza, że wydziela się ciepło.
Kwasy reagują z tlenkami metali. W wyniku reakcji powstaje sól i woda. Przykład: kwas siarkowy (H2SO4) reaguje z tlenkiem magnezu (MgO), tworząc siarczan magnezu (MgSO4) i wodę (H2O).
Podział kwasów
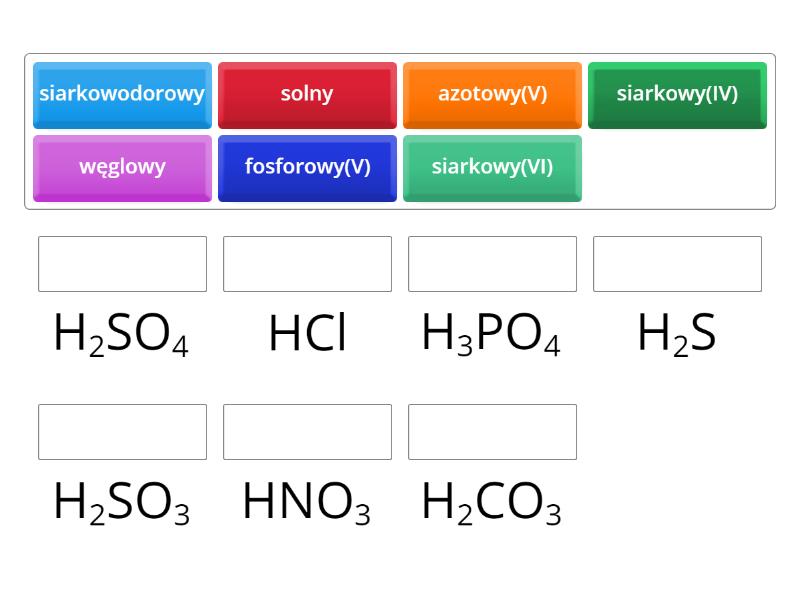
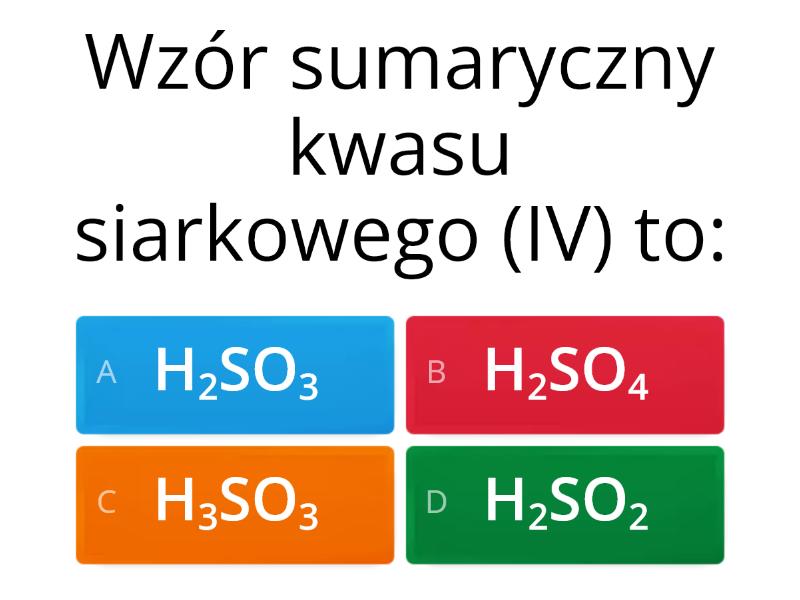
Kwasy dzielimy na różne sposoby. Ze względu na skład, dzielimy je na tlenowe i beztlenowe. Kwasy beztlenowe nie zawierają atomów tlenu. Przykładem jest kwas chlorowodorowy (HCl). Kwasy tlenowe zawierają atomy tlenu. Przykładem jest kwas siarkowy (H2SO4).
Ze względu na moc, kwasy dzielimy na mocne i słabe. Kwasy mocne ulegają całkowitej dysocjacji w wodzie. Oznacza to, że wszystkie cząsteczki kwasu rozpadają się na jony. Przykładem jest kwas solny (HCl) i kwas siarkowy (H2SO4). Kwasy słabe dysocjują tylko częściowo. Przykładem jest kwas octowy (CH3COOH).
Ważne jest, aby umieć rozróżniać kwasy mocne od słabych. Kwasy mocne są bardziej niebezpieczne i wymagają większej ostrożności podczas pracy z nimi.
Przykłady kwasów i ich zastosowanie
Kwas solny (HCl): Stosowany w przemyśle chemicznym. Używany do czyszczenia metali i produkcji innych związków chemicznych. Znajduje się również w żołądku, gdzie pomaga w trawieniu pokarmów.
Kwas siarkowy (H2SO4): Jeden z najważniejszych kwasów w przemyśle. Używany do produkcji nawozów, detergentów, tworzyw sztucznych i wielu innych produktów. Jest również stosowany w akumulatorach samochodowych.
Kwas azotowy (HNO3): Używany do produkcji nawozów sztucznych. Stosowany do produkcji materiałów wybuchowych i barwników. Ma silne właściwości utleniające.
Kwas octowy (CH3COOH): Znajduje się w occie. Używany w przemyśle spożywczym jako konserwant. Stosowany do produkcji tworzyw sztucznych i leków.
Kwas cytrynowy (C6H8O7): Występuje naturalnie w owocach cytrusowych. Używany w przemyśle spożywczym jako dodatek do żywności. Stosowany w kosmetykach i lekach.
Bezpieczeństwo pracy z kwasami
Praca z kwasami wymaga zachowania ostrożności. Należy stosować odpowiednie środki ochrony osobistej. Są to: okulary ochronne, rękawice ochronne i fartuch laboratoryjny.
W przypadku kontaktu kwasu ze skórą, należy natychmiast przemyć to miejsce dużą ilością wody. W razie potrzeby należy skonsultować się z lekarzem.
Kwasy należy przechowywać w odpowiednich pojemnikach. Muszą być szczelnie zamknięte i oznaczone. Przechowywać w miejscu niedostępnym dla dzieci.
Pamiętaj, że bezpieczeństwo jest najważniejsze. Przestrzegaj zasad BHP w laboratorium. Unikniesz niebezpiecznych sytuacji.
Podsumowanie
Kwasy to ważne związki chemiczne. Mają wiele zastosowań. Znajomość ich właściwości jest bardzo ważna. Zarówno w życiu codziennym, jak i w dalszej nauce chemii.
Zapamiętaj definicję kwasu. Naucz się rozróżniać kwasy mocne od słabych. Pamiętaj o zasadach bezpieczeństwa. Powodzenia na sprawdzianie!