Drodzy nauczyciele chemii klasy 7, przed nami jedno z fundamentalnych zagadnień – łączenie się atomów, równania reakcji chemicznych oraz cała związana z tym chemia. Często wydaje się to abstrakcyjne dla uczniów, ale właściwe podejście dydaktyczne może uczynić ten temat fascynującym i zrozumiałym.
Jak wyjaśnić łączenie się atomów?
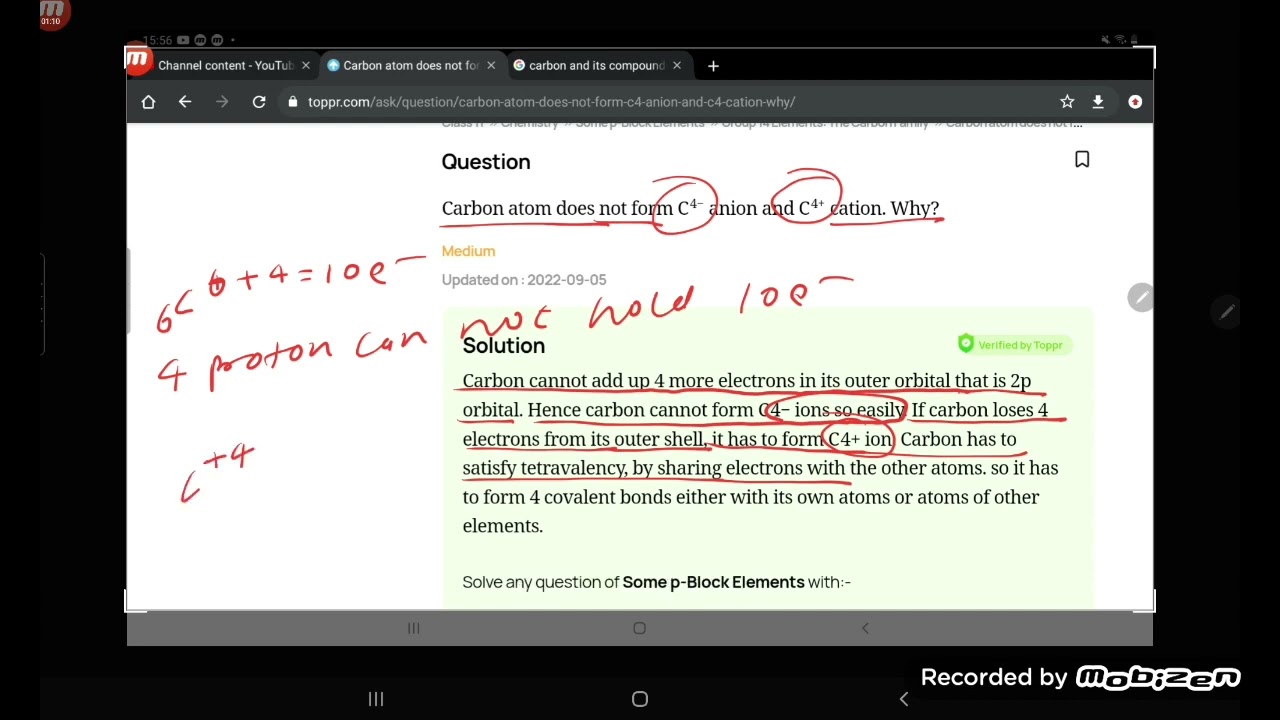
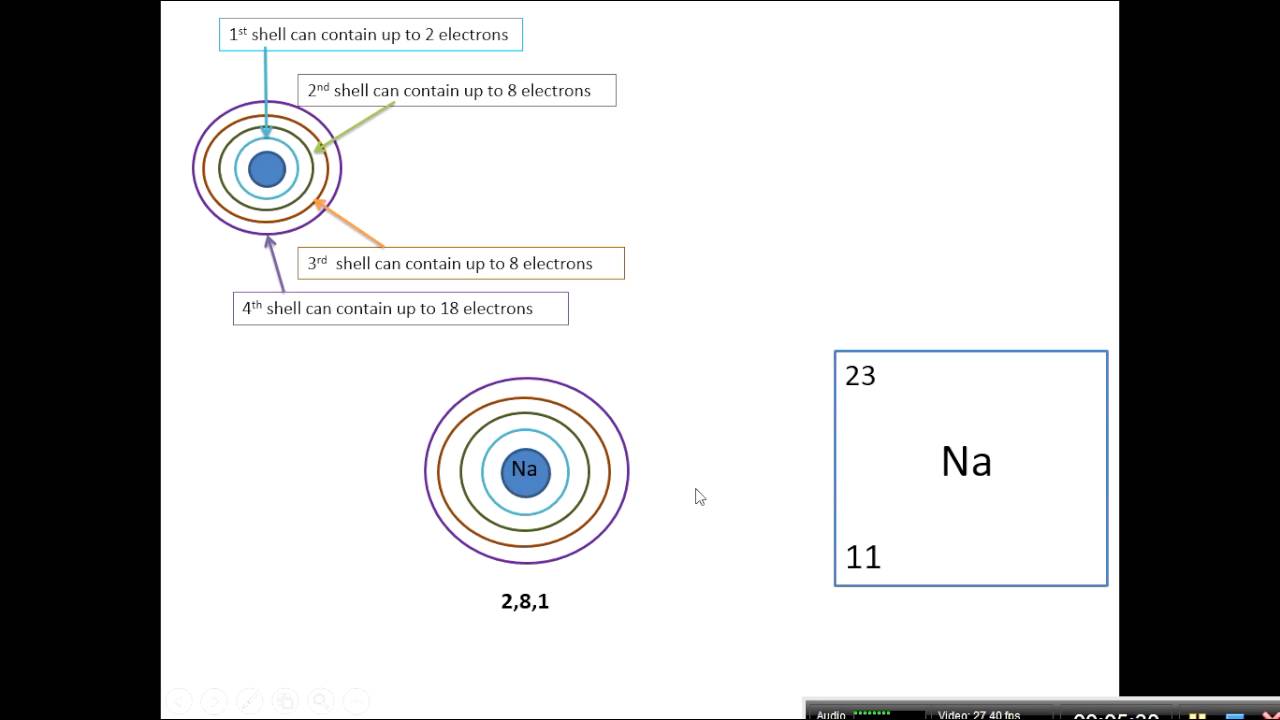
Zacznijmy od podstaw. Kluczem jest zrozumienie, dlaczego atomy w ogóle chcą się łączyć. Wyjaśnij, że atomy dążą do uzyskania stabilnej konfiguracji elektronowej, podobnej do gazów szlachetnych. Można użyć analogii – każdy atom "chce" mieć pełny "zestaw" elektronów. Wspomnij o regule oktetu i dubletu, ale bez przesadnego zagłębiania się w teorię kwantową na tym etapie. Najważniejsze jest, aby uczniowie zrozumieli ideę dążenia do stabilności.
Podkreśl różnicę między wiązaniami jonowymi i kowalencyjnymi. Wyjaśnij, że wiązanie jonowe powstaje poprzez transfer elektronów między atomami (tworząc jony), a wiązanie kowalencyjne poprzez uwspólnianie elektronów. Przykładem wiązania jonowego może być sól kuchenna (NaCl), gdzie sód oddaje elektron chlorowi, a przykładem wiązania kowalencyjnego cząsteczka wody (H2O), gdzie atomy wodoru i tlenu dzielą się elektronami. Użyj wizualizacji – rysunki, modele atomów z zaznaczonymi elektronami walencyjnymi. Modelowanie jest kluczowe!
Praktyczne wskazówki do lekcji:
- Użyj modeli: Modele atomów (np. z plasteliny, styropianu) i wiązań (np. z patyczków, drucików) pozwalają uczniom dosłownie "zobaczyć" proces łączenia się atomów. Dzięki temu abstrakcyjne pojęcie staje się bardziej konkretne.
- Analogia do życia codziennego: Wykorzystaj przykłady z życia codziennego, np. tworzenie się kryształków soli podczas odparowywania wody, rozpuszczanie cukru w wodzie (tworzenie się wiązań wodorowych).
- Zadania z kartami pracy: Przygotuj karty pracy, w których uczniowie będą musieli narysować powstawanie wiązań jonowych i kowalencyjnych dla różnych związków.
- Gry dydaktyczne: Zorganizuj grę, w której uczniowie wcielają się w role atomów i muszą znaleźć partnerów do utworzenia stabilnych cząsteczek.
Równania reakcji chemicznych – jak to ugryźć?
Przechodzimy do równań reakcji chemicznych. Tutaj ważna jest systematyczność. Zacznij od wyjaśnienia, co oznaczają symbole chemiczne i wzory chemiczne. Upewnij się, że uczniowie potrafią odczytywać i zapisywać podstawowe wzory, np. H2O, CO2, NaCl. Następnie wprowadź pojęcie równania reakcji jako zapisu procesu chemicznego. Wyjaśnij, że równanie reakcji musi być zbilansowane, co oznacza, że liczba atomów każdego pierwiastka po stronie reagentów (substratów) musi być równa liczbie atomów tego samego pierwiastka po stronie produktów.
Metoda bilansowania równań reakcji powinna być prosta i intuicyjna. Można zacząć od najprostszych reakcji, np. syntezy wody (2H2 + O2 → 2H2O). Pokaż krok po kroku, jak dobrać współczynniki stechiometryczne, aby liczba atomów była taka sama po obu stronach równania. Zastosuj metodę "prób i błędów" w początkowej fazie, a następnie wprowadź bardziej systematyczne metody, jeśli uczniowie będą gotowi. Ważne jest, aby uczniowie rozumieli, że współczynniki stechiometryczne informują o stosunku molowym reagentów i produktów.
Praktyczne wskazówki do lekcji:
- Wizualizacje: Użyj wizualizacji, np. animacji, które pokazują, jak atomy przemieszczają się i tworzą nowe wiązania podczas reakcji chemicznej.
- Modele: Ponownie modele atomów i cząsteczek są bardzo pomocne. Uczniowie mogą "budować" równanie reakcji z klocków i upewniać się, że liczba atomów po obu stronach jest taka sama.
- Zadania z kartami pracy: Przygotuj karty pracy z różnymi równaniami reakcji, które uczniowie będą musieli zbilansować. Zacznij od prostych równań, a następnie stopniowo zwiększaj poziom trudności.
- Ćwiczenia interaktywne: Wykorzystaj ćwiczenia interaktywne online, które pozwalają uczniom na bilansowanie równań reakcji w interaktywny sposób.
- Reakcje demonstracyjne: Przeprowadzaj proste reakcje demonstracyjne, np. reakcję kwasu octowego z sodą oczyszczoną, aby pokazać uczniom, że reakcje chemiczne naprawdę zachodzą.
Typowe błędy i nieporozumienia
Uczniowie często popełniają błędy w rozumieniu łączenia się atomów i równań reakcji chemicznych. Najczęstsze z nich to:
- Mylenie atomów z cząsteczkami: Uczniowie często nie rozróżniają atomu (np. atom wodoru) od cząsteczki (np. cząsteczka wodoru H2).
- Błędne rozumienie wiązań: Uczniowie mogą myśleć, że wiązania chemiczne są fizycznymi połączeniami, a nie siłami elektrostatycznymi.
- Problemy z bilansowaniem równań: Uczniowie często zapominają o zmianie współczynników stechiometrycznych przed całymi wzorami chemicznymi, a nie tylko przed poszczególnymi atomami.
- Nierozumienie zasady zachowania masy: Uczniowie mogą nie rozumieć, że liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania reakcji.
- Błędne interpretowanie wzorów chemicznych: Mylenie znaczenia indeksów dolnych (liczba atomów w cząsteczce) i współczynników stechiometrycznych (liczba cząsteczek w reakcji).
Ważne jest, aby aktywnie identyfikować te błędy i korygować je na bieżąco. Zadawaj pytania sprawdzające, proś uczniów o wyjaśnianie swoich rozumowań i dawaj im możliwość poprawiania swoich błędów.
Jak uczynić temat bardziej angażującym?
Chemia może wydawać się nudna, jeśli jest prezentowana w sposób suchy i teoretyczny. Spróbuj uczynić ją bardziej angażującą, wykorzystując następujące techniki:
- Powiązania z życiem codziennym: Pokaż, jak chemia jest obecna w naszym życiu codziennym – w jedzeniu, w kosmetykach, w lekach, w transporcie.
- Eksperymenty: Przeprowadzaj proste eksperymenty, które ilustrują omawiane zagadnienia. Pamiętaj o bezpieczeństwie!
- Filmy i animacje: Wykorzystaj filmy i animacje, które w ciekawy i przystępny sposób wyjaśniają trudne koncepcje.
- Gry i quizy: Zorganizuj gry i quizy, które sprawdzają wiedzę uczniów w zabawny sposób.
- Projekty badawcze: Zaproponuj uczniom wykonanie prostych projektów badawczych, np. badanie wpływu różnych czynników na szybkość reakcji chemicznej.
- Wykorzystaj technologię: Wykorzystaj interaktywne symulacje i aplikacje, które pozwalają uczniom eksperymentować z łączeniem się atomów i bilansowaniem równań reakcji w wirtualnym środowisku.
Pamiętaj, że kluczem do sukcesu jest cierpliwość, pozytywne nastawienie i umiejętność tłumaczenia trudnych zagadnień w prosty i zrozumiały sposób. Powodzenia!