Zacznijmy naszą podróż po wodorotlenkach! W klasie 8 poznajemy te związki chemiczne, które odgrywają ważną rolę w chemii. Spróbujemy je zrozumieć krok po kroku. Przygotuj się na fascynującą lekcję!
Czym są Wodorotlenki? Definicja i budowa
Wodorotlenki to związki chemiczne zbudowane z metalu i grupy hydroksylowej (OH⁻). Grupa hydroksylowa jest atomem tlenu połączonym z atomem wodoru. Brzmi skomplikowanie? Wcale nie musi! Pomyśl o nich jak o metalach, które "przyczepiły" do siebie grupę OH⁻. To właśnie grupa OH⁻ nadaje wodorotlenkom ich charakterystyczne właściwości.
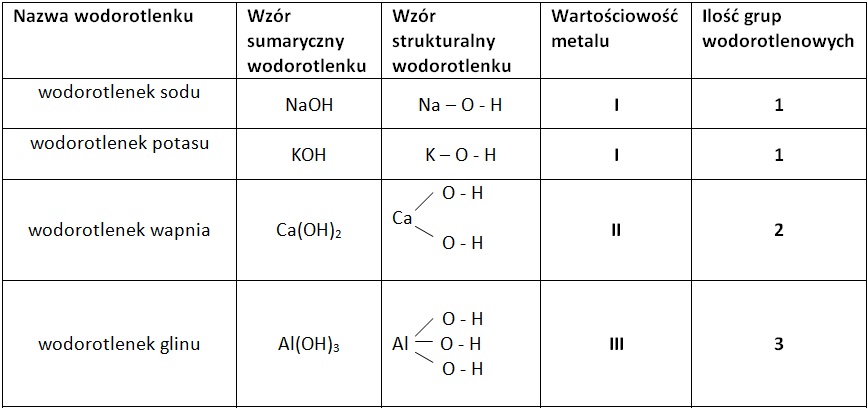
Wzór ogólny wodorotlenku to MeOH, gdzie "M" oznacza metal. Ale to nie wszystko! Metale mogą mieć różną wartościowość. To wpływa na liczbę grup OH⁻ w cząsteczce wodorotlenku. Dlatego wzory wodorotlenków bywają różne, np. NaOH, Ca(OH)₂, Al(OH)₃.
Nazwa wodorotlenku tworzona jest od nazwy metalu i dodawana jest końcówka "wodorotlenek". Na przykład NaOH to wodorotlenek sodu. Ca(OH)₂ to wodorotlenek wapnia. Pamiętaj, że jeśli metal ma więcej niż jedną wartościowość, trzeba ją podać w nawiasie po nazwie metalu. Na przykład wodorotlenek żelaza(II) to Fe(OH)₂ a wodorotlenek żelaza(III) to Fe(OH)₃.
Jak pisać wzory wodorotlenków?
Pamiętaj o wartościowościach! Wartościowość metalu określa liczbę grup OH⁻ w cząsteczce. Jeśli metal jest jednowartościowy (np. sód - Na, potas - K), to wzór będzie prosty: NaOH, KOH. Ale jeśli metal jest dwuwartościowy (np. wapń - Ca, magnez - Mg), to potrzebujemy dwóch grup OH⁻: Ca(OH)₂, Mg(OH)₂.
Gdy metal jest trójwartościowy (np. glin - Al), potrzebujemy aż trzech grup OH⁻: Al(OH)₃. Zauważ, że jeśli potrzebujemy więcej niż jednej grupy OH⁻, bierzemy ją w nawias. Pamiętaj o tym nawiasie! Jest bardzo ważny, żeby wzór był poprawny.
Przykład: Chcesz napisać wzór wodorotlenku żelaza(III). Żelazo ma wartościowość III. Zatem potrzebujemy trzech grup OH⁻. Wzór to Fe(OH)₃. Proste, prawda? Ćwicz pisanie wzorów, a szybko nabierzesz wprawy!
Właściwości Wodorotlenków
Wodorotlenki to substancje o różnych właściwościach. Stan skupienia wodorotlenków zależy od metalu, z którego są zbudowane. Niektóre są substancjami stałymi, np. wodorotlenek sodu (NaOH) czy wodorotlenek wapnia (Ca(OH)₂). Inne mogą występować w roztworach. Wodorotlenki litowców (np. NaOH, KOH) dobrze rozpuszczają się w wodzie.
Rozpuszczalność wodorotlenków ma duże znaczenie. Wodorotlenki, które dobrze rozpuszczają się w wodzie, nazywamy zasadami. Zasady mają odczyn zasadowy. To znaczy, że ich pH jest wyższe niż 7. Zasady reagują z kwasami, neutralizując je. To bardzo ważna reakcja w chemii!
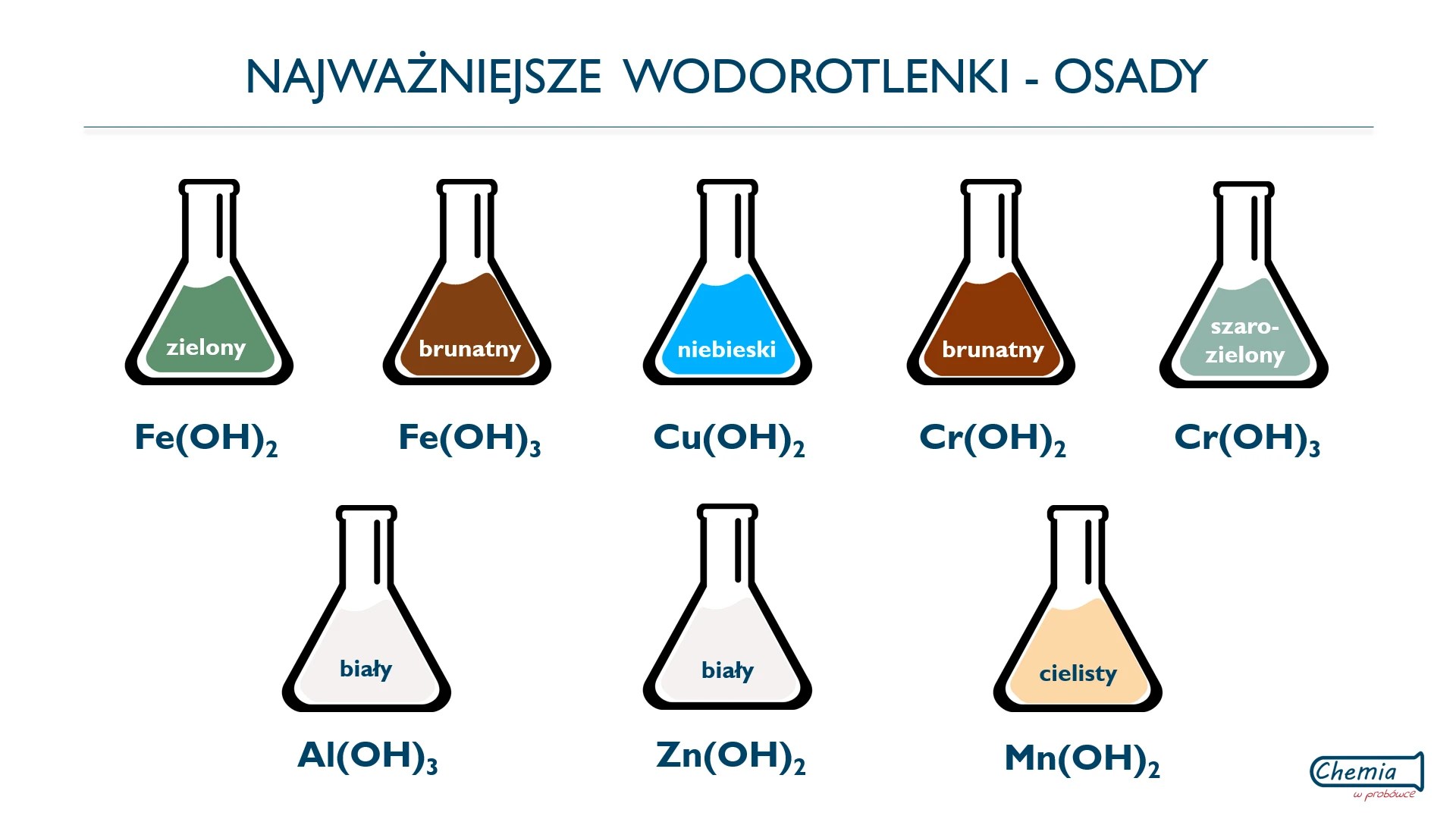
Wodorotlenki, które słabo rozpuszczają się w wodzie, tworzą osady. Osady to substancje stałe, które wypadają z roztworu. Kolor osadów może być różny. Na przykład wodorotlenek miedzi(II) Cu(OH)₂ ma kolor niebieski, a wodorotlenek żelaza(III) Fe(OH)₃ ma kolor rdzawobrązowy. Obserwacja kolorów osadów pomaga identyfikować różne wodorotlenki.
Zastosowanie Wodorotlenków
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach. Wodorotlenek sodu (NaOH), czyli soda kaustyczna, jest używany do produkcji mydła, papieru, detergentów. Stosuje się go również do udrażniania rur kanalizacyjnych. Pamiętaj, żeby używać go ostrożnie, bo jest żrący!
Wodorotlenek wapnia (Ca(OH)₂), czyli wapno gaszone, jest używany w budownictwie do zapraw murarskich i tynków. W rolnictwie stosuje się go do odkwaszania gleby. Wapno gaszone ma właściwości dezynfekujące.
Wodorotlenek magnezu (Mg(OH)₂) jest składnikiem leków zobojętniających kwas żołądkowy. Pomaga łagodzić zgagę i niestrawność. Znajdziesz go w popularnych preparatach na dolegliwości żołądkowe.
Reakcje charakterystyczne wodorotlenków
Jedną z najważniejszych reakcji wodorotlenków jest reakcja z kwasami, czyli reakcja neutralizacji. W tej reakcji wodorotlenek reaguje z kwasem, tworząc sól i wodę. Na przykład: NaOH + HCl → NaCl + H₂O. W tej reakcji wodorotlenek sodu reaguje z kwasem solnym, tworząc chlorek sodu (sól kuchenną) i wodę.
Inną charakterystyczną reakcją jest reakcja wodorotlenków z roztworami soli. W tej reakcji może powstać osad. Na przykład: CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl. W tej reakcji chlorek miedzi(II) reaguje z wodorotlenkiem sodu, tworząc osad wodorotlenku miedzi(II) (niebieski osad) i chlorek sodu.
Pamiętaj, że obserwacja reakcji wodorotlenków pozwala na identyfikację różnych substancji. Zmiana koloru, powstawanie osadu – to wszystko daje nam cenne informacje. Chemia jest fascynująca, prawda?
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć wodorotlenki. Teraz jesteś gotowy na sprawdzian z chemii! Powodzenia!