Witajcie, drodzy siódmoklasiści!
Przed nami sprawdzian z chemii. Nie martwcie się! Razem przejdziemy przez najważniejsze zagadnienia i wszystko sobie przypomnimy. Skupimy się na substancjach i ich przemianach. Gotowi? Zaczynamy!
I. Substancje i Mieszaniny
Substancja to materiał o określonych właściwościach. Ma stały skład chemiczny. Przykładem jest woda (H2O) czy sól kuchenna (NaCl).
Mieszanina to połączenie dwóch lub więcej substancji. Zachowują one swoje właściwości. Skład mieszaniny może być różny.
Podział Mieszanin
Mieszaniny dzielimy na dwie główne grupy:
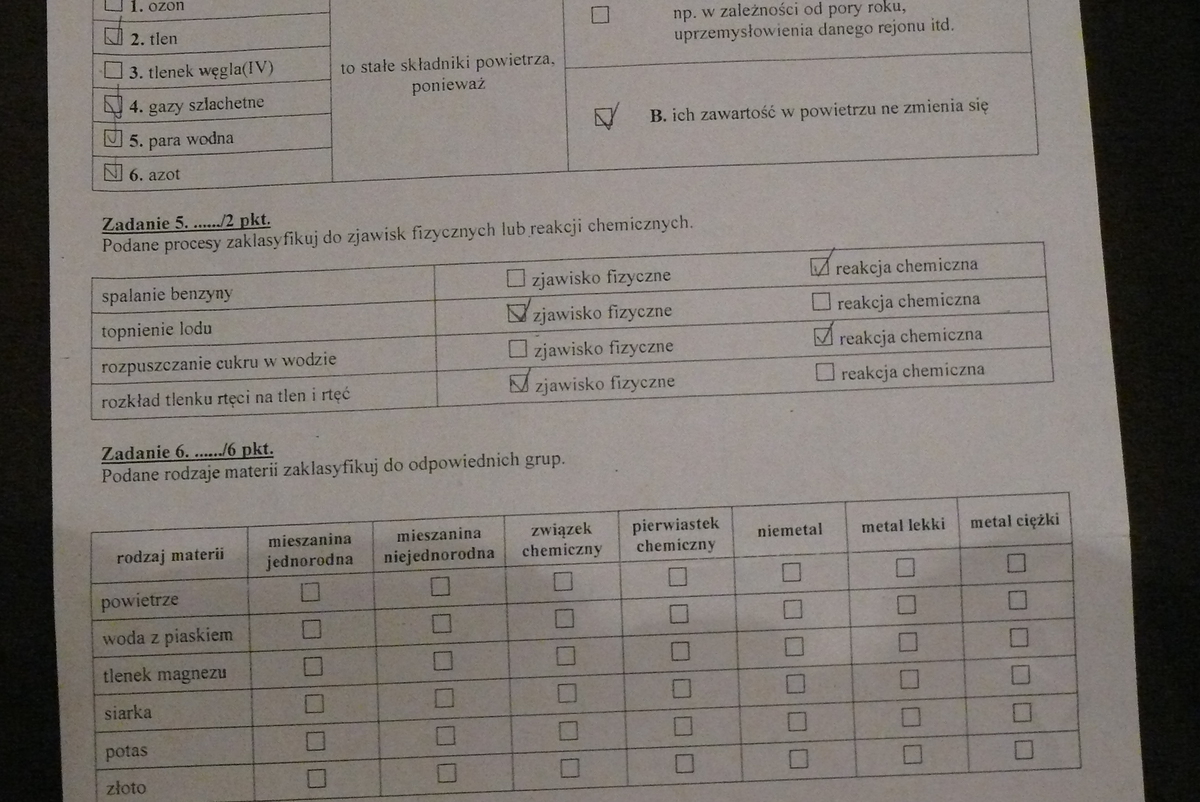
- Mieszaniny jednorodne (roztwory). Składniki są niewidoczne gołym okiem. Przykład: woda z solą, powietrze.
- Mieszaniny niejednorodne. Składniki są widoczne gołym okiem lub pod mikroskopem. Przykład: woda z piaskiem, mleko.
Metody Rozdzielania Mieszanin
Istnieje wiele sposobów na rozdzielenie mieszanin. Wybór metody zależy od rodzaju mieszaniny i właściwości składników.
- Dekantacja. Oddzielanie cieczy od osadu. Np. zlewanie wody znad piasku.
- Filtracja. Oddzielanie substancji stałej od cieczy lub gazu za pomocą filtra. Np. oddzielanie piasku od wody.
- Odparowanie. Oddzielanie substancji stałej rozpuszczonej w cieczy przez odparowanie cieczy. Np. otrzymywanie soli z roztworu wody z solą.
- Destylacja. Oddzielanie cieczy o różnych temperaturach wrzenia. Np. oddzielanie alkoholu od wody.
- Krystalizacja. Wydzielanie substancji stałej z roztworu w postaci kryształów.
- Rozdzielanie magnetyczne. Oddzielanie substancji o właściwościach magnetycznych. Np. oddzielanie opiłków żelaza od piasku.
II. Pierwiastki i Związki Chemiczne
Pierwiastek chemiczny to substancja prosta. Nie można jej rozłożyć na prostsze substancje metodami chemicznymi. Przykład: tlen (O), wodór (H), żelazo (Fe).
Związek chemiczny to substancja złożona. Powstaje przez połączenie dwóch lub więcej pierwiastków w określonym stosunku. Przykład: woda (H2O), dwutlenek węgla (CO2).
Wzór chemiczny to zapis symboliczny związku chemicznego. Informuje o rodzaju i liczbie atomów w cząsteczce. Na przykład, H2O oznacza, że cząsteczka wody składa się z dwóch atomów wodoru i jednego atomu tlenu.
Symbol chemiczny to skrócony zapis nazwy pierwiastka. Zwykle pochodzi od łacińskiej nazwy pierwiastka. Np. Na to symbol sodu (Natrium).
III. Reakcje Chemiczne
Reakcja chemiczna to proces, w którym jedne substancje (substraty) przekształcają się w inne (produkty). Towarzyszy jej zmiana właściwości substancji.
Równanie reakcji chemicznej to zapis symboliczny reakcji. Pokazuje substraty, produkty i ich stosunki ilościowe.
Przykładowe równanie reakcji: 2H2 + O2 → 2H2O. Oznacza to, że dwie cząsteczki wodoru reagują z jedną cząsteczką tlenu, tworząc dwie cząsteczki wody.
Rodzaje Reakcji Chemicznych
- Synteza (łączenie). Z dwóch lub więcej substratów powstaje jeden produkt. Np. S + O2 → SO2
- Analiza (rozkład). Z jednego substratu powstają dwa lub więcej produktów. Np. 2H2O → 2H2 + O2
- Wymiana. Atomy lub grupy atomów wymieniają się miejscami. Np. Zn + 2HCl → ZnCl2 + H2
Czynniki Wpływające na Szybkość Reakcji
Na szybkość reakcji chemicznej wpływają różne czynniki:
- Temperatura. Zwykle wzrost temperatury przyspiesza reakcję.
- Stężenie substratów. Zwykle wzrost stężenia substratów przyspiesza reakcję.
- Katalizator. Katalizator to substancja, która przyspiesza reakcję, ale sama w niej nie zużywa się.
- Stopień rozdrobnienia substratów. Im większy stopień rozdrobnienia, tym szybsza reakcja (zwłaszcza w przypadku substancji stałych).
IV. Prawo Zachowania Mas
Prawo zachowania masy mówi, że masa substratów jest równa masie produktów. Atomy nie giną ani nie powstają podczas reakcji chemicznej. Ulegają jedynie przegrupowaniu.
Dzięki temu prawu możemy bilansować równania reakcji chemicznych. Upewniamy się, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
V. Przemiany Fizyczne i Chemiczne
Przemiana fizyczna to zmiana stanu skupienia lub kształtu substancji. Nie zmienia się jej skład chemiczny. Przykład: topnienie lodu, wrzenie wody.
Przemiana chemiczna (reakcja chemiczna) to zmiana składu chemicznego substancji. Powstają nowe substancje o innych właściwościach. Przykład: spalanie drewna, rdzewienie żelaza.
Różnice między Przemianami Fizycznymi a Chemicznymi
W przemianach fizycznych nie powstają nowe substancje. Zmienia się tylko stan skupienia lub kształt. W przemianach chemicznych powstają nowe substancje o innych właściwościach.
Podsumowanie
Pamiętajcie! Na sprawdzianie najważniejsze jest:
- Rozróżnianie substancji i mieszanin.
- Podział mieszanin na jednorodne i niejednorodne.
- Metody rozdzielania mieszanin.
- Rozróżnianie pierwiastków i związków chemicznych.
- Zapisywanie wzorów i symboli chemicznych.
- Definicja reakcji chemicznej.
- Rodzaje reakcji chemicznych (synteza, analiza, wymiana).
- Czynniki wpływające na szybkość reakcji.
- Prawo zachowania masy.
- Rozróżnianie przemian fizycznych i chemicznych.
Powodzenia na sprawdzianie! Wierzę w Was!