Hej! Przygotowujesz się do sprawdzianu z budowy atomu i układu okresowego? Super! Razem damy radę!
Budowa atomu
Podstawowe pojęcia
Atom to podstawowy składnik materii. Pamiętaj o tym!
Składa się z jądra atomowego i elektronów krążących wokół niego.
Jądro atomowe zawiera protony i neutrony.
Protony mają ładunek dodatni (+). Neutrony są obojętne (nie mają ładunku).
Elektrony mają ładunek ujemny (-).
Liczby atomowe i masowe
Liczba atomowa (Z) to liczba protonów w jądrze atomowym. To ona identyfikuje pierwiastek.
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym.
Możesz obliczyć liczbę neutronów: A - Z = liczba neutronów.
Na przykład, dla węgla (C) o Z=6 i A=12: 12 - 6 = 6 neutronów.
Izotopy
Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów.
Mają taką samą liczbę protonów (czyli taką samą liczbę atomową), ale różną liczbę masową.
Na przykład, węgiel-12 (12C) i węgiel-14 (14C) to izotopy węgla.
Konfiguracja elektronowa
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na powłokach elektronowych wokół jądra atomowego.
Elektrony zajmują określone powłoki elektronowe (K, L, M, N...).
Każda powłoka może pomieścić określoną liczbę elektronów (2n2, gdzie n to numer powłoki).
Powłoka K (n=1) może pomieścić 2 elektrony.
Powłoka L (n=2) może pomieścić 8 elektronów.
Powłoka M (n=3) może pomieścić 18 elektronów.
Elektrony walencyjne to elektrony znajdujące się na ostatniej powłoce elektronowej. Decydują o właściwościach chemicznych pierwiastka.
Zapis konfiguracji elektronowej: np. dla sodu (Na, Z=11): 1s2 2s2 2p6 3s1 lub K:2 L:8 M:1
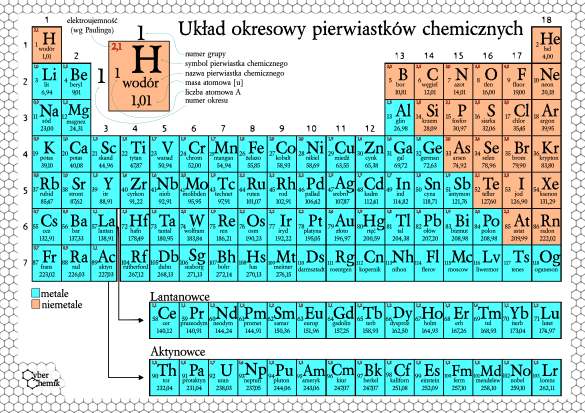
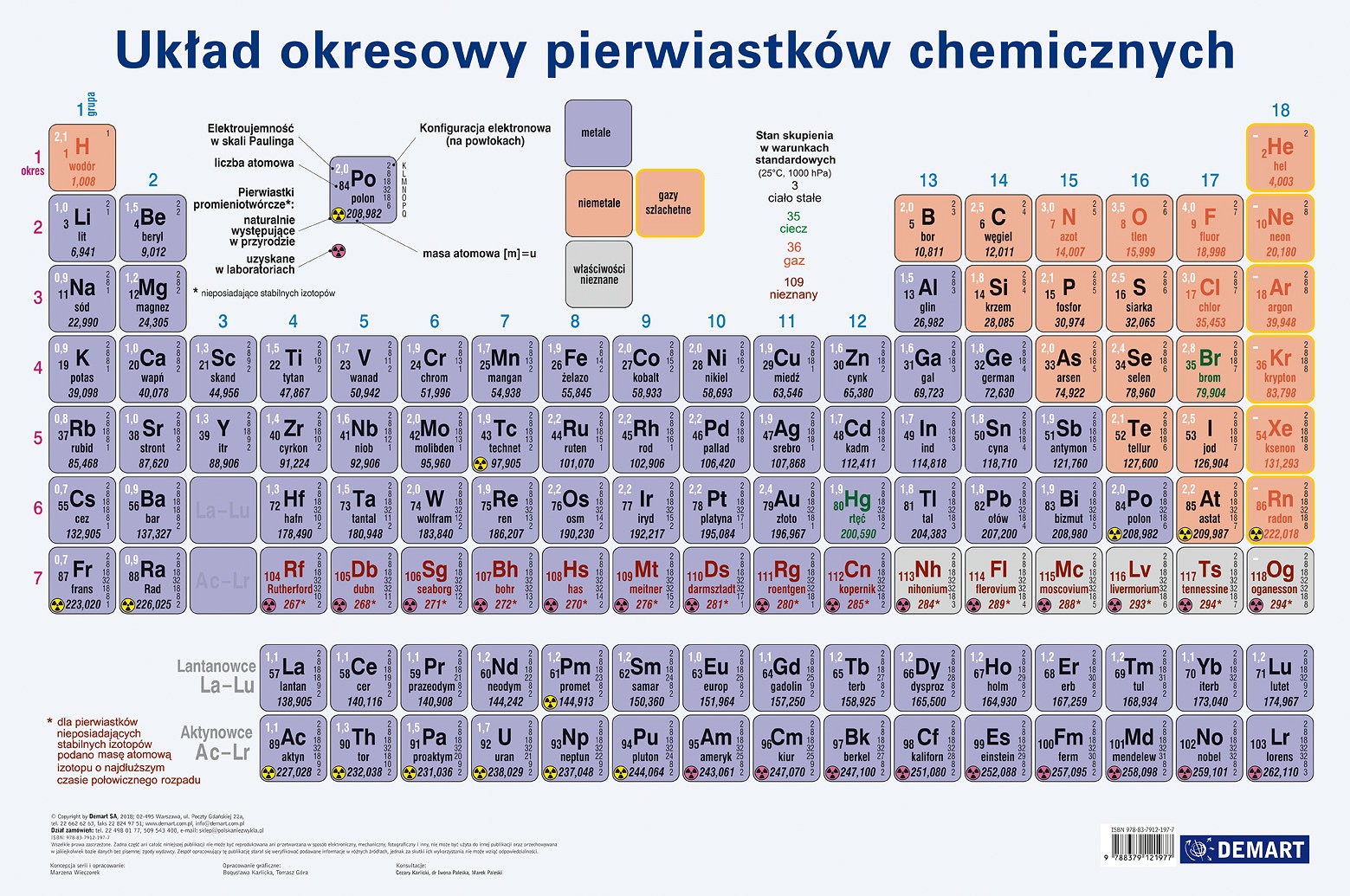
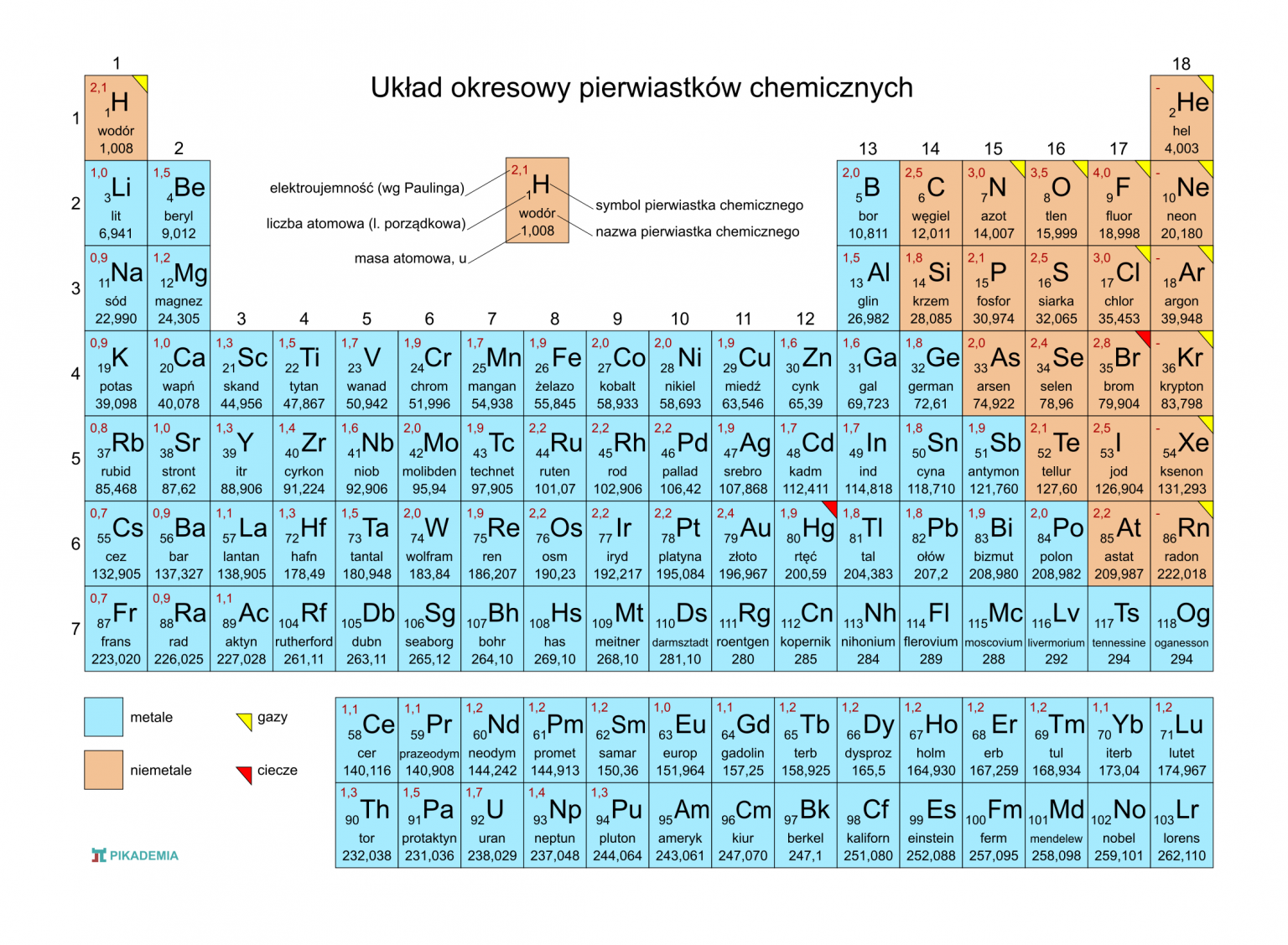
Układ okresowy pierwiastków chemicznych
Budowa układu okresowego
Układ okresowy to uporządkowana tabela pierwiastków chemicznych.
Okresy to poziome rzędy w układzie okresowym. Numer okresu odpowiada liczbie powłok elektronowych w atomach pierwiastków danego okresu.
Grupy to pionowe kolumny w układzie okresowym. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ mają taką samą liczbę elektronów walencyjnych.
Podział pierwiastków
W układzie okresowym wyróżniamy metale, niemetale i półmetale.
Metale zazwyczaj są dobre przewodnikami ciepła i elektryczności, mają połysk, są kowalne i ciągliwe.
Niemetale zazwyczaj są słabymi przewodnikami ciepła i elektryczności, nie mają połysku, są kruche.
Półmetale mają właściwości pośrednie między metalami a niemetalami.
Właściwości pierwiastków w grupach i okresach
Właściwości pierwiastków zmieniają się w sposób regularny w grupach i okresach.
Promień atomowy na ogół maleje w okresie (od lewej do prawej) i rośnie w grupie (z góry na dół).
Elektroujemność (zdolność atomu do przyciągania elektronów) na ogół rośnie w okresie (od lewej do prawej) i maleje w grupie (z góry na dół).
Energia jonizacji (energia potrzebna do oderwania elektronu od atomu) na ogół rośnie w okresie (od lewej do prawej) i maleje w grupie (z góry na dół).
Wybrane grupy pierwiastków
Litowce (grupa 1) to bardzo reaktywne metale.
Berylkowce (grupa 2) to reaktywne metale.
Halogeny (grupa 17) to bardzo reaktywne niemetale.
Gazy szlachetne (grupa 18) to bardzo niereaktywne gazy.
Zadania i przykłady
Spróbuj rozwiązać kilka zadań, aby utrwalić wiedzę. Na przykład:
1. Określ liczbę protonów, neutronów i elektronów w atomie tlenu (O), jeśli Z=8 i A=16.
2. Napisz konfigurację elektronową dla potasu (K), jeśli Z=19.
3. Gdzie w układzie okresowym znajduje się pierwiastek o konfiguracji elektronowej 1s2 2s2 2p4?
Podsumowanie
Pamiętaj o najważniejszych pojęciach:
Atom, jądro atomowe, proton, neutron, elektron.
Liczba atomowa, liczba masowa, izotopy.
Konfiguracja elektronowa, powłoki elektronowe, elektrony walencyjne.
Układ okresowy, okresy, grupy, metale, niemetale, półmetale.
Powodzenia na sprawdzianie! Wierzę w Ciebie!