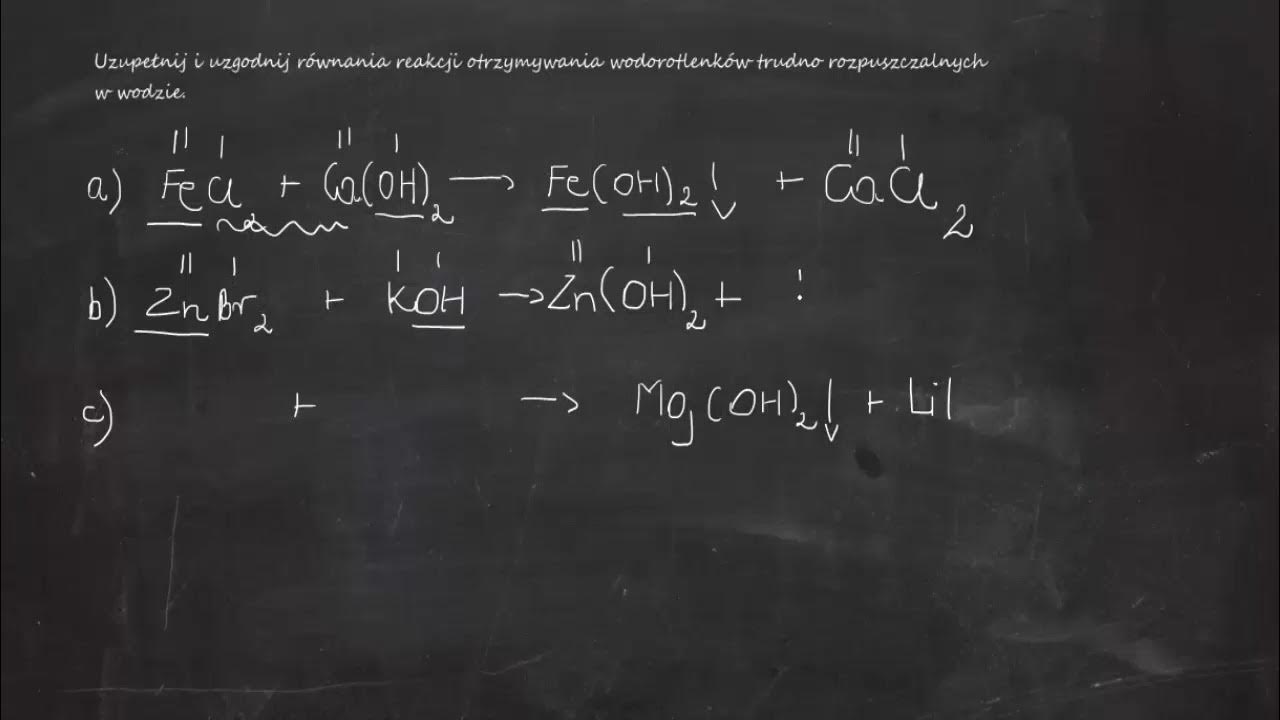Otrzymywanie wodorotlenków to kluczowy temat w chemii nieorganicznej. Uczniowie często mają trudności z zrozumieniem procesów zachodzących podczas reakcji. Ważne jest, aby przedstawić temat w sposób jasny i uporządkowany, z naciskiem na praktyczne przykłady i doświadczenia.
Metale Aktywne i Woda
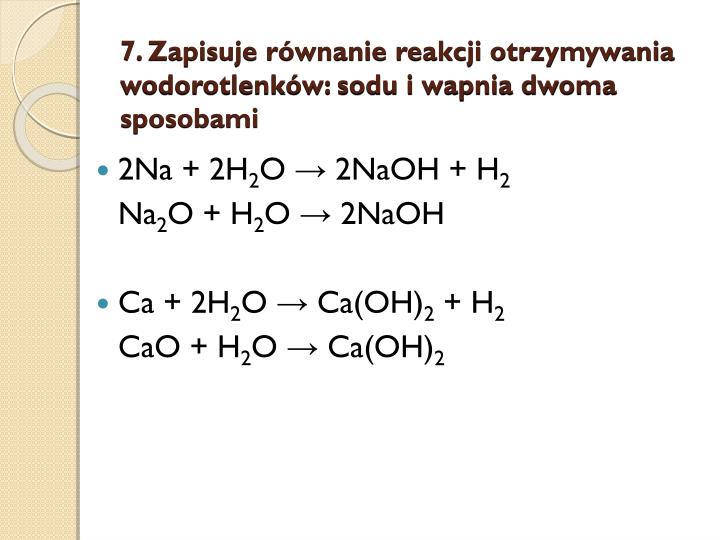
Reakcja metali aktywnych (np. litu, sodu, potasu, wapnia, baru) z wodą prowadzi do powstania wodorotlenku i wydzielenia wodoru. To jeden z podstawowych sposobów otrzymywania wodorotlenków. Pamiętaj o pokazaniu uczniom równania reakcji, na przykład: 2Na + 2H2O → 2NaOH + H2. Zwróć uwagę na właściwe bilansowanie równań reakcji.
Wyjaśnij uczniom, że aktywność metali rośnie w grupie układu okresowego. Oznacza to, że reakcja potasu z wodą będzie bardziej gwałtowna niż reakcja sodu. Demonstracja (przy zachowaniu wszelkich środków ostrożności!) różnic w reaktywności może być bardzo efektowna.
Praktyczne Wskazówki dla Nauczycieli
Zacznij od przypomnienia uczniom pojęcia metali alkalicznych i metali ziem alkalicznych. Wyjaśnij, dlaczego te metale są tak aktywne chemicznie. Zwróć uwagę na ich konfigurację elektronową i tendencję do oddawania elektronów.
Podczas demonstracji używaj małych ilości metali i zachowaj szczególną ostrożność. Upewnij się, że uczniowie rozumieją zagrożenia związane z reakcją metali aktywnych z wodą. Ważne jest, aby podkreślić, że reakcja przebiega z wydzieleniem ciepła i wodoru, który jest gazem łatwopalnym.
Możesz poprosić uczniów o napisanie równań reakcji dla różnych metali aktywnych. Sprawdź, czy poprawnie zbilansowali równania. To dobry sposób na sprawdzenie ich zrozumienia tematu. Wykorzystaj karty pracy z zadaniami o różnym stopniu trudności, aby zróżnicować proces nauczania.
Tlenki Metali i Woda
Tlenki metali grup 1 i 2 układu okresowego reagują z wodą tworząc wodorotlenki. Na przykład, tlenek sodu reaguje z wodą tworząc wodorotlenek sodu: Na2O + H2O → 2NaOH. To kolejna ważna metoda otrzymywania wodorotlenków.
Podkreśl, że nie wszystkie tlenki metali reagują z wodą. Tlenki metali przejściowych na ogół nie rozpuszczają się w wodzie. Ważne jest, aby uczniowie zrozumieli, jakie tlenki reagują z wodą, a jakie nie. Wyjaśnij to, odwołując się do charakteru wiązania metal-tlen i polarności związku.
Praktyczne Wskazówki dla Nauczycieli
Wyjaśnij uczniom pojęcie tlenków zasadowych. Zwiąż to z kwasowo-zasadowym charakterem tlenków. Użyj prostych przykładów, aby zilustrować różnicę między tlenkami zasadowymi, kwasowymi i amfoterycznymi.
Możesz przeprowadzić proste doświadczenie, polegające na dodaniu tlenku wapnia do wody. Obserwuj zmiany temperatury i sprawdź odczyn roztworu za pomocą wskaźnika. To pomoże uczniom zrozumieć proces powstawania wodorotlenku. Pamiętaj o bezpieczeństwie podczas przeprowadzania doświadczeń.
Poproś uczniów o przewidywanie produktów reakcji różnych tlenków metali z wodą. Zachęć ich do uzasadniania swoich odpowiedzi. To pobudzi ich myślenie krytyczne i pomoże im lepiej zrozumieć omawiane zagadnienie. Możesz również wykorzystać modele molekularne do wizualizacji procesu reakcji.
Reakcje Wymiany
Wodorotlenki można również otrzymać w wyniku reakcji wymiany. Na przykład, reakcja roztworu soli metalu z roztworem wodorotlenku. Reakcja zachodzi, jeśli powstaje osad wodorotlenku. Jest to szczególnie przydatne w przypadku otrzymywania wodorotlenków metali, które nie reagują bezpośrednio z wodą.
Przykładem jest reakcja chlorku żelaza(III) z wodorotlenkiem sodu: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Powstaje osad wodorotlenku żelaza(III). Wyjaśnij, dlaczego wodorotlenki niektórych metali są nierozpuszczalne w wodzie.
Praktyczne Wskazówki dla Nauczycieli
Przypomnij uczniom pojęcie rozpuszczalności soli i wodorotlenków. Wykorzystaj tablice rozpuszczalności, aby uczniowie mogli przewidywać, czy dana reakcja zajdzie, czy nie. Naucz ich korzystać z tych tablic.
Przeprowadź doświadczenie, w którym uczniowie będą mieszać roztwory różnych soli z roztworami wodorotlenków. Obserwuj powstawanie osadów. Poproś uczniów o zapisanie równań reakcji i określenie, które wodorotlenki są nierozpuszczalne.
Zadawaj pytania sprawdzające zrozumienie, np. "Czy reakcja chlorku miedzi(II) z wodorotlenkiem potasu zajdzie? Jeśli tak, to jaki osad się wytrąci?". To pomoże uczniom utrwalić wiedzę. Stwórz zestaw pytań i odpowiedzi, aby uczniowie mogli samodzielnie sprawdzić swoją wiedzę.
Typowe Błędy i Nieporozumienia
Uczniowie często mylą tlenki z wodorotlenkami. Ważne jest, aby wyraźnie pokazać różnicę w budowie i właściwościach tych związków. Zwróć uwagę na obecność grupy -OH w wodorotlenkach.
Kolejnym błędem jest mylenie pojęcia aktywności metali. Uczniowie mogą sądzić, że wszystkie metale reagują z wodą. Wyjaśnij, że tylko metale aktywne reagują z wodą. Podkreśl rolę potencjału standardowego elektrod i szeregu elektrochemicznego metali.
Uczniowie mogą mieć trudności z bilansowaniem równań reakcji. Upewnij się, że rozumieją zasadę zachowania masy. Daj im dużo okazji do ćwiczeń w bilansowaniu równań. Wykorzystaj programy komputerowe lub aplikacje mobilne do bilansowania równań reakcji, aby uatrakcyjnić naukę.
Podsumowanie
Otrzymywanie wodorotlenków to ważny temat w chemii. Wykorzystaj różne metody nauczania, aby pomóc uczniom zrozumieć procesy zachodzące podczas reakcji. Pamiętaj o praktycznych przykładach i doświadczeniach. Regularnie sprawdzaj wiedzę uczniów i koryguj błędy. Zachęcaj uczniów do zadawania pytań i aktywnego uczestnictwa w lekcji.