Drodzy nauczyciele!
Temat reakcji utleniania-redukcji (redoks) i elektrochemii bywa trudny dla uczniów. Przygotowanie sprawdzianu z tego zakresu wymaga przemyślenia.
Wyjaśnianie Podstaw
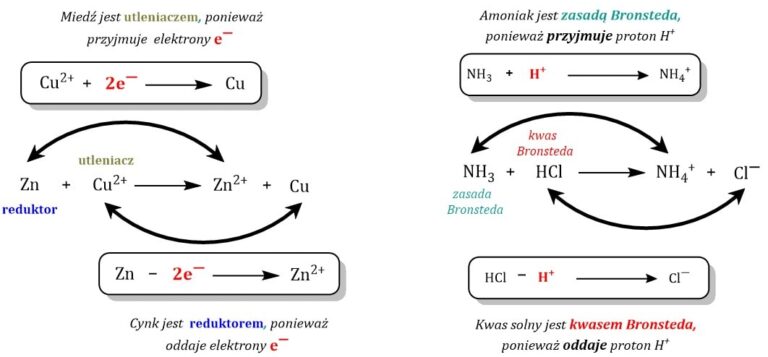
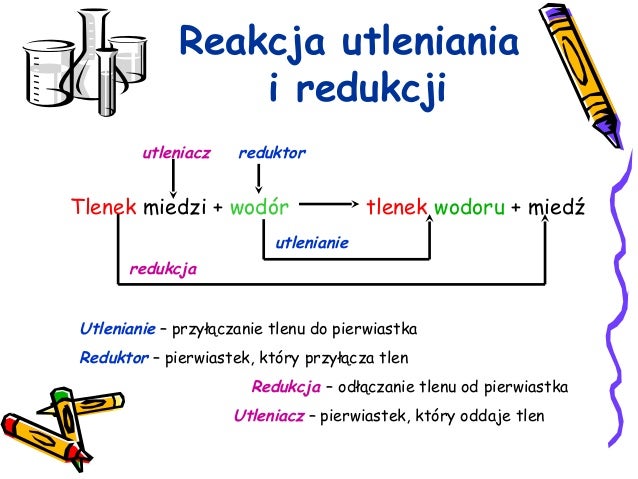
Zacznijmy od podstaw. Utlenianie to proces oddawania elektronów.
Redukcja to proces przyjmowania elektronów.
Pamiętajcie o mnemonikach. Na przykład: "OIL RIG" (Oxidation Is Loss, Reduction Is Gain). Może pomóc zapamiętać, co się dzieje z elektronami.
Liczba utlenienia to ładunek, jaki atom miałby, gdyby elektrony były przypisane do bardziej elektroujemnego atomu.
Obliczanie liczb utlenienia to klucz. Uczniowie muszą to ćwiczyć.
Podkreślcie, że utlenianie i redukcja zawsze zachodzą razem. Nie ma jednego bez drugiego.
Wskazówki dla Nauczyciela:
- Używajcie przykładów z życia codziennego.
- Wyjaśniajcie krok po kroku.
- Proście uczniów o samodzielne obliczanie liczb utlenienia.
Elektrochemia: Ogniwa i Elektroliza
Elektrochemia to dział chemii zajmujący się związkami między energią elektryczną a reakcjami chemicznymi.
Ogniwo galwaniczne (ogniwo Volty) wykorzystuje spontaniczną reakcję redoks do generowania energii elektrycznej.
Elektroliza wykorzystuje energię elektryczną do wymuszenia niespontanicznej reakcji redoks.
Wyjaśnijcie budowę ogniwa: anoda (utlenianie), katoda (redukcja), elektrolit, mostek solny.
Zwróćcie uwagę na kierunek przepływu elektronów i jonów.
Omówcie potencjał standardowy elektrody. Uczniowie muszą wiedzieć, jak go używać.
Równanie Nernsta pozwala obliczyć potencjał ogniwa w warunkach niestandardowych.
Wyjaśnijcie prawa elektrolizy Faradaya. Powiązanie ilości przepływającego ładunku z ilością produktu.
Wskazówki dla Nauczyciela:
- Pokażcie schematy ogniw i procesów elektrolizy.
- Wykorzystajcie symulacje komputerowe.
- Ćwiczcie obliczenia związane z potencjałem ogniwa i elektrolizą.
Typowe Błędy i Jak Ich Unikać
Uczniowie często mylą utlenianie z redukcją. Podkreślajcie różnicę.
Błędy w obliczaniu liczb utlenienia są powszechne. Sprawdzajcie obliczenia uczniów.
Zła interpretacja schematów ogniw. Wyjaśniajcie krok po kroku, co się dzieje w każdej części ogniwa.
Zapominanie o bilansowaniu równań redoks. To krytyczne!
Nie rozumienie koncepcji spontaniczności reakcji. Wyjaśniajcie związek z potencjałem ogniwa.
Sposoby Zapobiegania Błędom:
- Regularne powtórki materiału.
- Dużo zadań do samodzielnego rozwiązania.
- Analiza błędów popełnianych przez uczniów.
Sprawdzian: Co Warto Uwzględnić?
Sprawdzian powinien sprawdzać zrozumienie koncepcji, a nie tylko zapamiętanie faktów.
Zadania otwarte pozwalają ocenić umiejętność analizy i argumentacji.
Zadania obliczeniowe sprawdzają umiejętność stosowania wzorów i praw.
Pytania testowe (wielokrotnego wyboru) mogą być użyte do sprawdzenia wiedzy podstawowej.
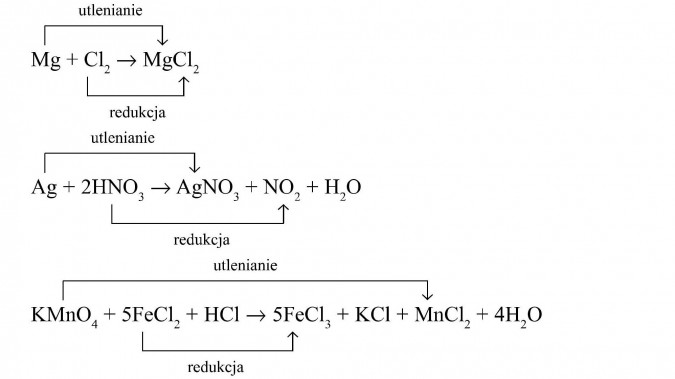
Równania reakcji do uzupełnienia lub zbilansowania.
Schematy ogniw do opisania.
Przykładowe zadania:
- Oblicz liczbę utlenienia manganu w KMnO4.
- Zbilansuj równanie reakcji: Fe2+ + MnO4- → Fe3+ + Mn2+ (w środowisku kwasowym).
- Narysuj schemat ogniwa Daniella i opisz zachodzące procesy.
- Oblicz potencjał standardowy ogniwa, w którym zachodzi reakcja: Zn + Cu2+ → Zn2+ + Cu.
- Oblicz masę miedzi, która wydzieli się na katodzie podczas elektrolizy roztworu CuSO4, jeśli przepłynie prąd o natężeniu 2 A przez 30 minut.
Jak Uatrakcyjnić Naukę?
Przeprowadzajcie doświadczenia. Np. proste ogniwo z cytryny i dwóch różnych metali.
Wykorzystujcie prezentacje multimedialne z animacjami.
Organizujcie konkursy z nagrodami. Np. na najlepsze rozwiązanie zadania.
Korzystajcie z zasobów internetowych. Np. interaktywne symulacje.
Zadawajcie pytania problemowe, które wymagają myślenia krytycznego.
Zachęcajcie do dyskusji i wymiany poglądów.
Używajcie metafor i analogii. Np. porównajcie przepływ elektronów do przepływu wody.
Pokażcie, jak reakcje redoks są wykorzystywane w praktyce. Np. w akumulatorach, korozji, produkcji metali.
Pamiętajcie, cierpliwość i entuzjazm są kluczowe!
Powodzenia w przygotowaniu sprawdzianu!