Witajcie! Dziś zajmiemy się reakcjami otrzymywania wodorotlenków. To temat, który na pierwszy rzut oka może wydawać się skomplikowany, ale obiecuję, że razem go rozłożymy na czynniki pierwsze. Zaczniemy od podstaw, a potem przejdziemy do konkretnych przykładów. Przygotujcie się na dawkę wiedzy, która przyda się na pewno!
Czym są wodorotlenki?
Zanim zaczniemy mówić o tym, jak je otrzymywać, musimy zrozumieć, czym właściwie są wodorotlenki. To związki chemiczne, które zawierają grupę hydroksylową, czyli OH-. Grupa ta łączy się z atomem metalu (najczęściej). Wodorotlenki mają charakter zasadowy, co oznacza, że w roztworze wodnym podwyższają pH.
Możemy je rozpoznać po tym, że ich nazwa kończy się na "wodorotlenek". Na przykład, wodorotlenek sodu (NaOH), albo wodorotlenek wapnia (Ca(OH)2). Pomyślcie o nich jak o takich "chemicznych bazach", które neutralizują kwasy. Właśnie, dlatego często używa się ich w przemyśle, na przykład do produkcji mydła!
Sposoby otrzymywania wodorotlenków
Istnieje kilka głównych metod otrzymywania wodorotlenków. Każda z nich ma swoje zalety i wady, i jest stosowana w zależności od tego, jaki wodorotlenek chcemy uzyskać. Przyjrzymy się teraz najpopularniejszym z nich. Spróbujemy zrozumieć, co się dzieje na poziomie atomów i cząsteczek.
1. Reakcja metali aktywnych z wodą
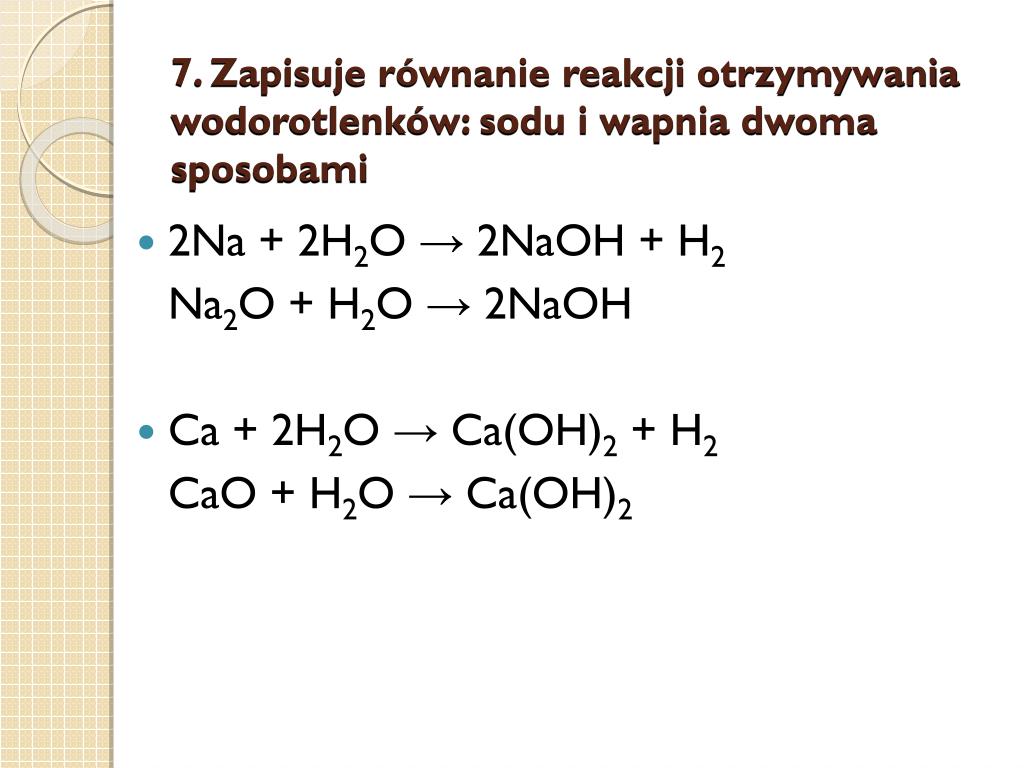
Metale aktywne, takie jak lit (Li), sód (Na), potas (K), wapń (Ca) i bar (Ba), reagują bezpośrednio z wodą. W wyniku tej reakcji powstaje wodorotlenek danego metalu i wydziela się wodór (H2). Ta reakcja jest często dość gwałtowna i egzotermiczna, czyli wydziela się dużo ciepła. Wyobraźcie sobie to jak małą eksplozję (oczywiście, w kontrolowanych warunkach!).
Przykład: Reakcja sodu z wodą: 2Na + 2H2O → 2NaOH + H2. Widzimy, że dwa atomy sodu reagują z dwiema cząsteczkami wody, tworząc dwie cząsteczki wodorotlenku sodu i jedną cząsteczkę wodoru. Pamiętajcie, żeby nigdy nie próbować tego w domu bez nadzoru osoby dorosłej, ponieważ wodór jest łatwopalny!
2. Reakcja tlenków metali z wodą
Niektóre tlenki metali reagują z wodą, tworząc odpowiednie wodorotlenki. Ta metoda jest szczególnie przydatna do otrzymywania wodorotlenków metali z grup 1 i 2 układu okresowego. Reakcja ta zazwyczaj przebiega spokojniej niż reakcja metali aktywnych z wodą.
Przykład: Reakcja tlenku wapnia z wodą: CaO + H2O → Ca(OH)2. Tlenek wapnia, znany również jako wapno palone, reaguje z wodą tworząc wodorotlenek wapnia, czyli wapno gaszone. Wapno gaszone jest używane w budownictwie jako składnik zapraw murarskich. To właśnie ta reakcja sprawia, że zaprawa twardnieje!
3. Reakcja soli z zasadami (wymiana podwójna)
Czasami wodorotlenki można otrzymać w wyniku reakcji między solą i zasadą. Ta reakcja nazywana jest reakcją wymiany podwójnej, lub inaczej reakcją strąceniową. Warunkiem zajścia tej reakcji jest, aby jeden z produktów był nierozpuszczalny w wodzie (czyli wytrącał się w postaci osadu).
Przykład: Reakcja chlorku żelaza(III) z wodorotlenkiem sodu: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. W tej reakcji powstaje nierozpuszczalny wodorotlenek żelaza(III), który wytrąca się w postaci brunatnego osadu. Strzałka w dół (↓) oznacza, że dany związek jest nierozpuszczalny i tworzy osad.
4. Elektroliza roztworów soli
Elektroliza to proces rozkładu substancji za pomocą prądu elektrycznego. Możemy ją wykorzystać do otrzymywania wodorotlenków z roztworów soli. W wyniku elektrolizy roztworu soli metalu alkalicznego, na katodzie wydziela się wodór, a w pobliżu katody gromadzą się jony wodorotlenkowe (OH-), tworząc wodorotlenek.
Przykład: Elektroliza roztworu chlorku sodu (NaCl): 2NaCl + 2H2O → 2NaOH + Cl2 + H2. W wyniku elektrolizy powstaje wodorotlenek sodu (NaOH), chlor (Cl2) i wodór (H2). Ten proces jest bardzo ważny w przemyśle chemicznym, ponieważ pozwala na jednoczesne otrzymywanie wodorotlenku sodu i chloru, które mają szerokie zastosowanie.
Podsumowanie
Mam nadzieję, że teraz rozumiecie, jak otrzymuje się wodorotlenki. Pamiętajcie, że najważniejsze to zrozumieć mechanizm każdej reakcji. Znamy już cztery główne metody: reakcję metali aktywnych z wodą, reakcję tlenków metali z wodą, reakcję soli z zasadami (wymiana podwójna) oraz elektrolizę roztworów soli.
Każda z tych metod ma swoje specyficzne zastosowania. Wybór konkretnej metody zależy od tego, jaki wodorotlenek chcemy otrzymać i jakie mamy dostępne surowce. Nie bójcie się eksperymentować (oczywiście, w bezpiecznych warunkach i pod nadzorem!), bo chemia to nauka praktyczna. Teraz wiecie, jak powstają wodorotlenki, więc możecie spróbować przewidywać, jakie produkty powstaną w różnych reakcjach. Powodzenia!