Hej! Przygotowujesz się do sprawdzianu z reakcji chemicznych w roztworach wodnych? Super! Pokażemy Ci, jak to ugryźć.
Co to w ogóle jest roztwór wodny?
Wyobraź sobie, że robisz herbatę. Woda to rozpuszczalnik. Herbata (a właściwie to, co się z niej rozpuszcza) to substancja rozpuszczona.
Połączenie wody i herbaty? To właśnie roztwór wodny!
W chemii, woda (H2O) jest bardzo popularnym rozpuszczalnikiem. Dużo reakcji zachodzi właśnie w niej.
Dlaczego woda jest tak fajna?
Woda jest jak mały magnes. Ma częściowo ładunek dodatni (na atomach wodoru) i częściowo ładunek ujemny (na atomie tlenu).
Dzięki temu "przyciąga" inne substancje, zwłaszcza te, które też mają ładunki – czyli jony.
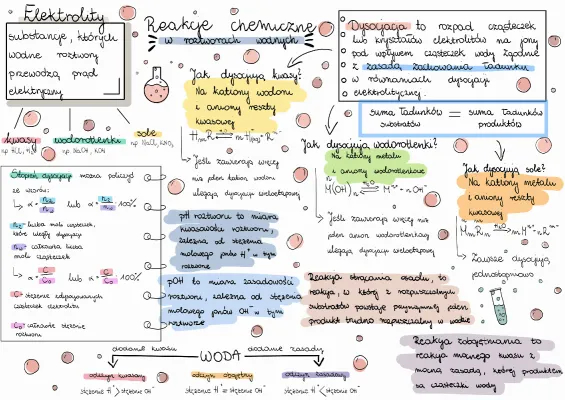
Dysocjacja elektrolityczna – rozpad na jony
Dysocjacja elektrolityczna to inaczej rozpad związku chemicznego na jony pod wpływem wody.
Pomyśl o soli kuchennej (NaCl). To kryształek. Kiedy wrzucisz go do wody, woda "rozbija" go na jony Na+ i Cl-.
Te jony "pływają" swobodnie w wodzie. Dzięki temu roztwór przewodzi prąd! Dlatego NaCl to elektrolit.
Nie wszystkie substancje dysocjują w wodzie. Cukier się rozpuszcza, ale nie rozpada się na jony. Dlatego roztwór cukru nie przewodzi prądu. Cukier to nieelektrolit.
Rodzaje reakcji w roztworach wodnych
Teraz najważniejsze – co się dzieje, kiedy zmieszamy ze sobą różne roztwory?
Reakcje strąceniowe
Wyobraź sobie dwa roztwory. W jednym są jony srebra (Ag+), a w drugim jony chlorkowe (Cl-).
Kiedy je zmieszasz, nagle... pojawia się biały osad! To chlorek srebra (AgCl). Jest nierozpuszczalny w wodzie i dlatego "wypada" z roztworu.
To jest właśnie reakcja strąceniowa. Dwa jony "spotykają się" i tworzą związek nierozpuszczalny, czyli osad.
Do zapamiętania: Nie wszystkie kombinacje jonów tworzą osady. Potrzebna jest tabela rozpuszczalności, żeby sprawdzić, co się wytrąci.
Reakcje kwasowo-zasadowe (neutralizacja)
Kwas reaguje z zasadą. To jak spotkanie dwóch przeciwieństw!
Kwas ma dużo jonów wodorowych (H+). Zasada ma dużo jonów wodorotlenkowych (OH-).
Kiedy je zmieszasz, H+ i OH- łączą się, tworząc... wodę (H2O)!
Dodatkowo powstaje sól. Np. kwas solny (HCl) + zasada sodowa (NaOH) -> sól (NaCl) + woda (H2O).
To jest właśnie neutralizacja. Kwas i zasada "neutralizują się" nawzajem.
Można to zobaczyć, używając wskaźników (indykatorów). Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Np. papierek uniwersalny albo fenoloftaleina.
Reakcje redoks (utleniania-redukcji)
Reakcje redoks to inaczej reakcje, w których zmienia się stopień utlenienia atomów.
Jeden atom odda elektrony (utlenianie). Drugi atom przyjmuje elektrony (redukcja).
Pomyśl o rdzewieniu żelaza. Żelazo (Fe) oddaje elektrony tlenowi (O2) z powietrza. Żelazo się utlenia, a tlen redukuje.
Żeby zrozumieć reakcje redoks, trzeba znać stopnie utlenienia. To "umowne" ładunki, które przypisujemy atomom w związkach.
Zapis jonowy i jonowy skrócony
Kiedy piszemy równania reakcji w roztworach, możemy użyć zapisu cząsteczkowego, jonowego i jonowego skróconego.
Zapis cząsteczkowy pokazuje całe związki, np. NaCl + AgNO3 -> AgCl + NaNO3.
Zapis jonowy rozpisuje wszystkie związki na jony, jeśli są elektrolitami, np. Na+ + Cl- + Ag+ + NO3- -> AgCl + Na+ + NO3-.
Zapis jonowy skrócony pokazuje tylko jony, które biorą udział w reakcji. Czyli te, które się zmieniają. W powyższym przykładzie: Ag+ + Cl- -> AgCl.
Jony, które "tylko patrzą" na reakcję (czyli te, które się nie zmieniają) to jony widzowe (spectator ions).
Stechiometria w roztworach
Stechiometria to obliczenia związane z ilościami reagentów i produktów w reakcji chemicznej.
W roztworach ważne jest pojęcie stężenia molowego (mol/L). Mówi nam, ile moli substancji rozpuszczono w litrze roztworu.
Możemy użyć stężenia molowego i objętości roztworu, żeby obliczyć liczbę moli substancji. A potem – używając równania reakcji – obliczyć, ile produktu powstanie.
To jak przepis na ciasto! Potrzebujesz odpowiednich proporcji składników, żeby ciasto wyszło idealne.
Kilka wskazówek na koniec
Zawsze pisz poprawne wzory chemiczne i równania reakcji. Bilansuj je! Sprawdzaj tabele rozpuszczalności.
Rysuj sobie schematy! Wizualizacja pomaga zrozumieć, co się dzieje.
Rozwiązuj dużo zadań. Praktyka czyni mistrza!
Powodzenia na sprawdzianie!