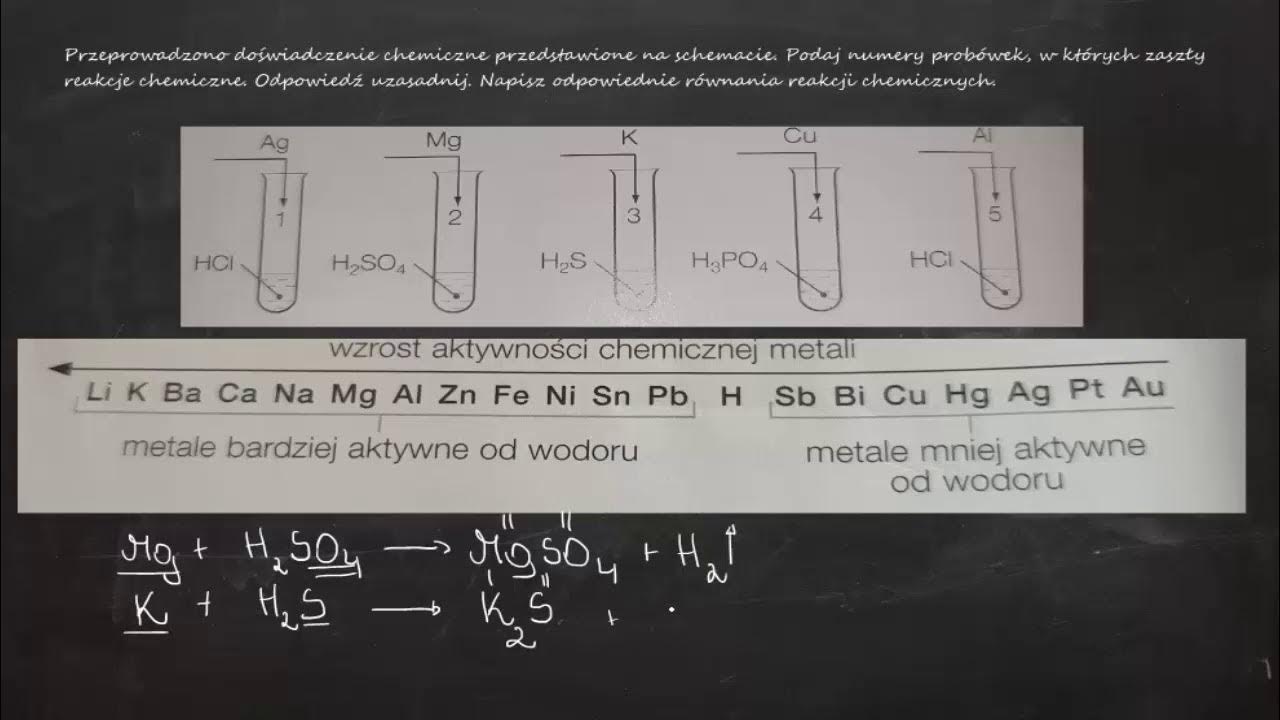
W tym artykule omówimy, jak przeprowadzane jest doświadczenie chemiczne mające na celu otrzymywanie kwasu chlorowodorowego (HCl). Jest to jedno z podstawowych doświadczeń w chemii nieorganicznej, demonstrujące ważne reakcje i właściwości związków chemicznych.
Reakcja Syntezy: Podstawowy Sposób Otrzymywania HCl
Najpopularniejszą metodą otrzymywania kwasu chlorowodorowego w warunkach laboratoryjnych jest synteza bezpośrednia z pierwiastków. Wymaga ona użycia wodoru (H2) i chloru (Cl2).
Opis Reakcji:
Reakcja chemiczna zachodzi według równania:
H2(g) + Cl2(g) → 2HCl(g)
Wodór i chlor, oba w stanie gazowym, reagują ze sobą, tworząc gazowy chlorowodór (HCl).
Przebieg Doświadczenia:
- Przygotowanie gazów: Wodór i chlor muszą być przygotowane w odpowiednich proporcjach. Najczęściej wykorzystuje się komercyjne źródła tych gazów, dbając o ich czystość.
- Mieszanie gazów: Gazy są ostrożnie mieszane w specjalnym naczyniu reakcyjnym. Należy zachować szczególną ostrożność, ponieważ mieszanina wodoru i chloru jest wybuchowa w pewnych proporcjach.
- Inicjacja reakcji: Reakcja syntezy wymaga inicjacji. Można to zrobić na kilka sposobów:
- Światło UV: Naświetlanie mieszaniny światłem ultrafioletowym (UV) dostarcza energii potrzebnej do rozerwania wiązań w cząsteczkach wodoru i chloru, rozpoczynając reakcję łańcuchową.
- Iskra elektryczna: Użycie iskry elektrycznej również może zainicjować reakcję.
- Ogrzewanie: Intensywne ogrzewanie mieszaniny również prowadzi do zapoczątkowania reakcji.
- Przebieg reakcji: Po zainicjowaniu, reakcja przebiega gwałtownie, z wydzieleniem dużej ilości ciepła (reakcja egzotermiczna). Powstaje gazowy chlorowodór.
- Absorpcja chlorowodoru w wodzie: Gazowy chlorowodór jest następnie absorbowany w wodzie. Proces ten nazywany jest absorpcją.
- Otrzymywanie kwasu chlorowodorowego: Rozpuszczenie gazowego chlorowodoru w wodzie prowadzi do powstania kwasu chlorowodorowego (HCl(aq)).
Schemat Aparatury (uproszczony):
Typowy schemat aparatury obejmuje:
- Źródła gazów (H2 i Cl2) z zaworami regulacyjnymi
- Naczynie reakcyjne (kwarcowe lub szklane) odporne na wysokie temperatury
- Źródło światła UV lub generator iskry
- Układ chłodzenia (ze względu na wydzielane ciepło)
- Absorber (naczynie z wodą, w którym rozpuszcza się HCl)
Otrzymywanie Kwasu Chlorowodorowego z Soli
Inną metodą, stosowaną często w laboratoriach, jest reakcja mocnego kwasu z chlorkiem, najczęściej z chlorkiem sodu (NaCl), czyli solą kuchenną. Wykorzystuje się do tego kwas siarkowy (VI) (H2SO4), który jest mocniejszym kwasem od kwasu chlorowodorowego i może wypierać go z soli.
Opis Reakcji:
Reakcja chemiczna zachodzi według równania:
NaCl(s) + H2SO4(l) → NaHSO4(s) + HCl(g)
Chlorek sodu w stanie stałym reaguje z kwasem siarkowym(VI) w stanie ciekłym, tworząc wodorosiarczan sodu (NaHSO4) i gazowy chlorowodór.
W wyższych temperaturach (powyżej 200°C) reakcja może przebiegać dalej:
NaCl(s) + NaHSO4(s) → Na2SO4(s) + HCl(g)
Chlorek sodu reaguje z powstałym wcześniej wodorosiarczanem sodu tworząc siarczan sodu (Na2SO4) i gazowy chlorowodór.
Przebieg Doświadczenia:
- Przygotowanie reagentów: Należy przygotować suchy chlorek sodu i stężony kwas siarkowy(VI).
- Umieszczenie reagentów w naczyniu: Chlorek sodu umieszcza się w kolbie, a następnie dodaje się ostrożnie kwas siarkowy(VI).
- Ogrzewanie: Kolbę ogrzewa się. Temperatura ogrzewania zależy od tego, którą reakcję chcemy przeprowadzić (temperatura niższa lub wyższa).
- Odbieranie gazowego chlorowodoru: Wydzielający się gazowy chlorowodór jest zbierany i przepuszczany przez absorber z wodą.
- Absorpcja chlorowodoru w wodzie: Gazowy chlorowodór jest absorbowany w wodzie, tworząc kwas chlorowodorowy.
Schemat Aparatury (uproszczony):
Typowy schemat aparatury obejmuje:
- Kolba reakcyjna
- Palnik lub płyta grzewcza
- Chłodnica (opcjonalnie, do skraplania ewentualnych zanieczyszczeń)
- Absorber z wodą
Bezpieczeństwo
Otrzymywanie kwasu chlorowodorowego wymaga zachowania szczególnej ostrożności ze względu na:
- Żrące właściwości HCl: Zarówno gazowy chlorowodór, jak i kwas chlorowodorowy są silnie żrące i mogą powodować poważne oparzenia skóry, oczu i dróg oddechowych.
- Toksyczność chloru: Chlor jest gazem toksycznym, a wdychanie go może prowadzić do poważnych problemów z oddychaniem.
- Wybuchowość mieszaniny wodoru i chloru: Mieszanina wodoru i chloru jest wybuchowa w pewnych proporcjach, co wymaga ostrożnego mieszania gazów i kontrolowania warunków reakcji.
- Reakcja egzotermiczna: Reakcja syntezy jest egzotermiczna, co oznacza, że wydziela się dużo ciepła. Należy kontrolować temperaturę reakcji, aby uniknąć przegrzania i potencjalnych problemów.
Zawsze należy stosować odpowiednie środki ochrony osobistej, takie jak okulary ochronne, rękawice i fartuch laboratoryjny. Doświadczenie powinno być przeprowadzane pod wyciągiem laboratoryjnym, aby uniknąć wdychania szkodliwych gazów. Ważne jest, aby znać procedury postępowania w przypadku awarii i mieć dostęp do pierwszej pomocy.
Zastosowania Kwasu Chlorowodorowego
Kwas chlorowodorowy ma szerokie zastosowanie w przemyśle i laboratoriach:
- Przemysł chemiczny: Do produkcji różnych związków chemicznych, takich jak chlorki metali, tworzywa sztuczne, nawozy.
- Przemysł metalurgiczny: Do trawienia metali, usuwania rdzy i osadów.
- Przemysł spożywczy: Do produkcji żelatyny, hydrolizy skrobi.
- Laboratoria: Jako odczynnik analityczny, do regulacji pH.
- Oczyszczanie wody: Do regulacji pH w procesach uzdatniania wody.
Podsumowując, doświadczenie otrzymywania kwasu chlorowodorowego jest istotnym elementem edukacji chemicznej, pozwalającym na zrozumienie fundamentalnych reakcji i właściwości związków nieorganicznych. Przeprowadzanie tego doświadczenia wymaga jednak dużej ostrożności i przestrzegania zasad bezpieczeństwa.