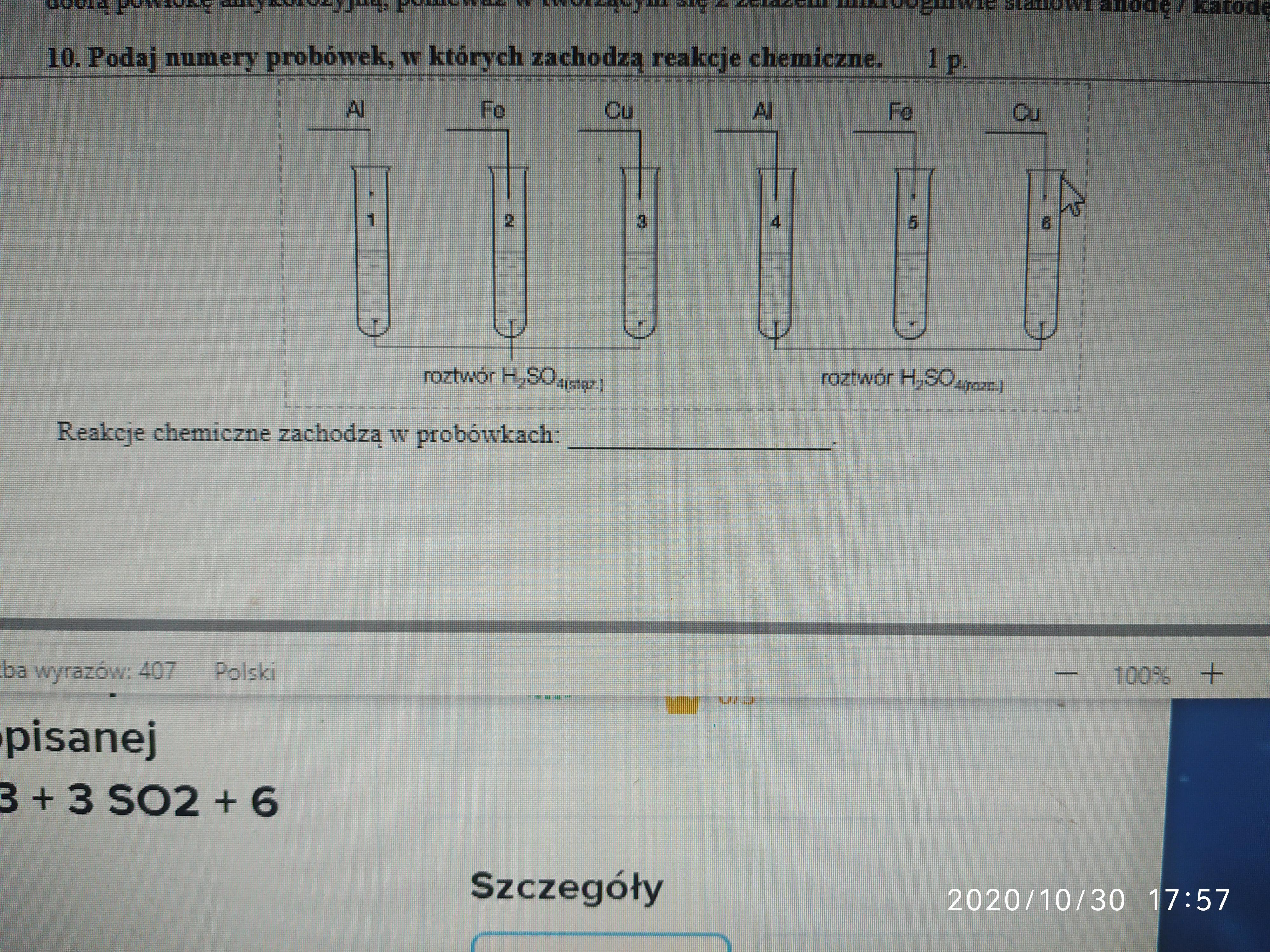
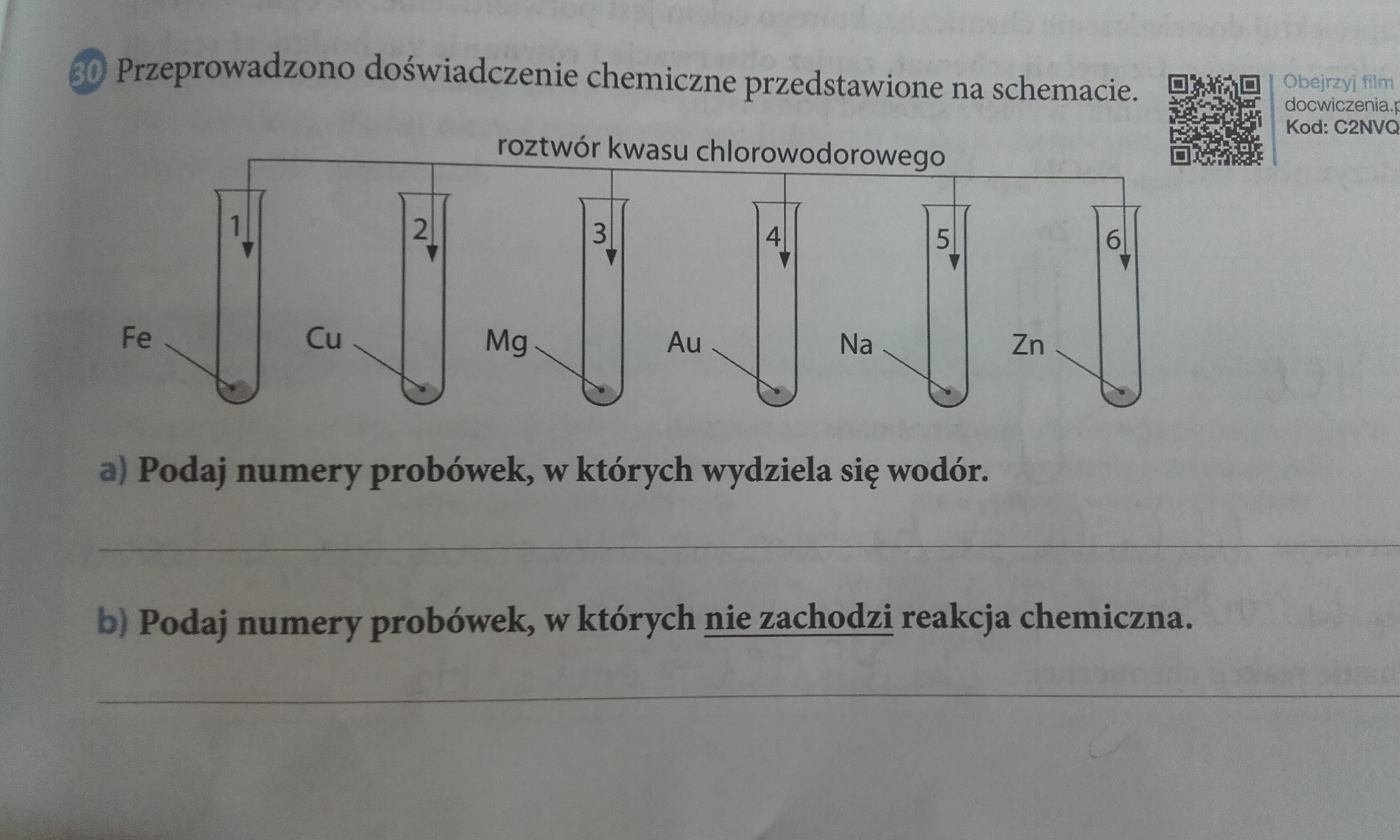
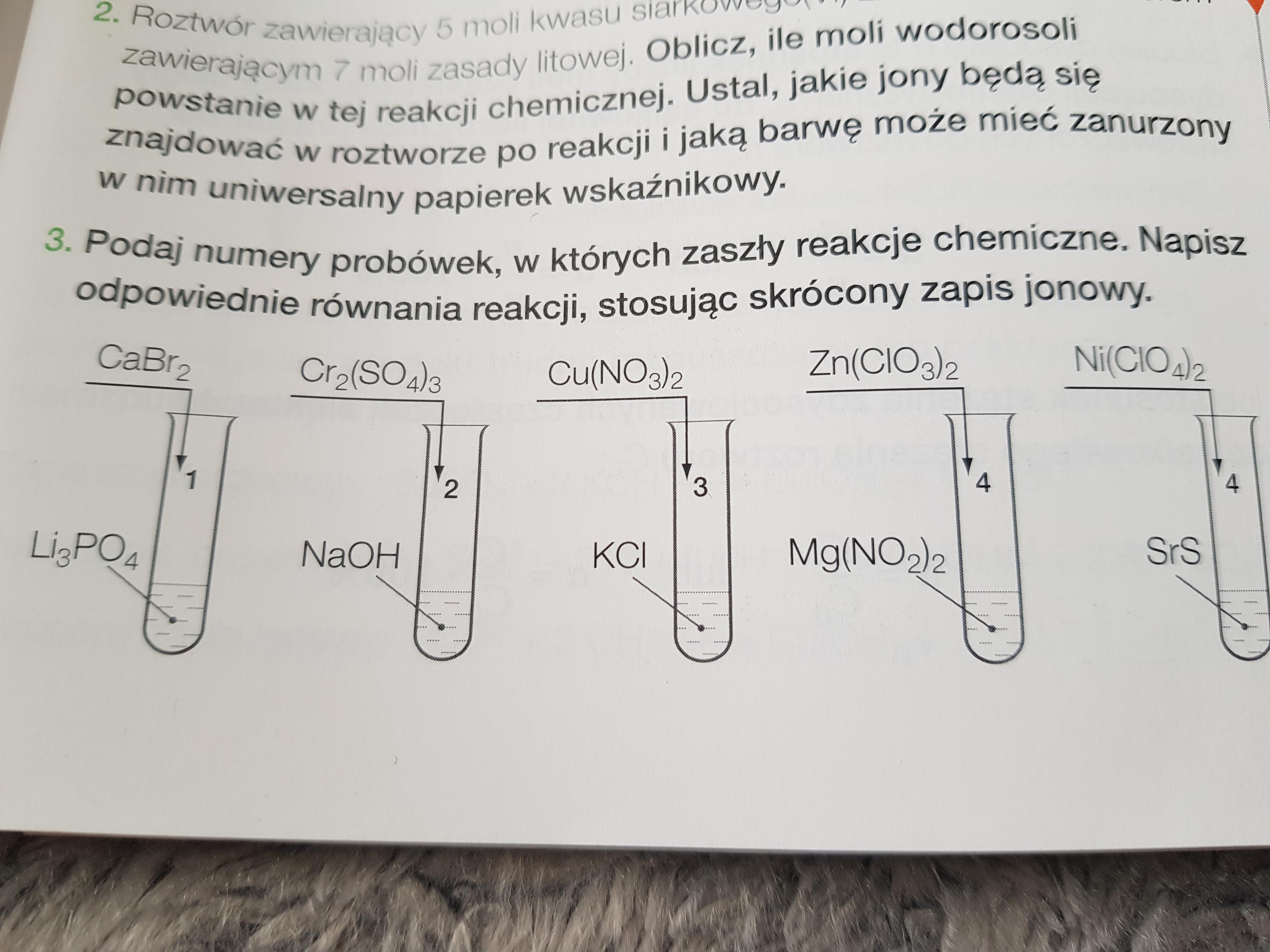
Określanie, w których probówkach zachodzą reakcje chemiczne, wymaga obserwacji i analizy. Zmiany są kluczowe.
Obserwacja Wizualna
Kolor, osad, gaz – wszystko to ma znaczenie. Spójrzmy na szczegóły.
Zmiana Koloru
Nagła zmiana barwy roztworu sugeruje reakcję. Na przykład, roztwór z bezbarwnego staje się niebieski. To znak, że coś się wydarzyło.
Przykład: Dodanie chlorku żelaza(III) do roztworu zawierającego jony tiocyjanianowe (SCN-) powoduje powstanie intensywnie czerwonego kompleksu [Fe(SCN)]2+. Bezbarwny roztwór staje się czerwony.
Powstawanie Osadu
Pojawienie się nierozpuszczalnej substancji stałej, czyli osadu, wskazuje na reakcję strąceniową. Mieszanka staje się mętna.
Przykład: Połączenie roztworu azotanu srebra (AgNO3) z roztworem chlorku sodu (NaCl) prowadzi do wytrącenia białego osadu chlorku srebra (AgCl).
Uwalnianie Gazu
Bąbelki, pęcherzyki, wydzielanie gazu – to jasne sygnały. Sprawdź, co się ulotniło.
Przykład: Dodanie kwasu solnego (HCl) do węglanu wapnia (CaCO3) powoduje wydzielanie się bezbarwnego gazu – dwutlenku węgla (CO2).
Zmiany Temperatury
Reakcje zmieniają temperaturę. Ciepło albo zimno – to czuć.
Reakcje Egzotermiczne
Uwalnianie ciepła, wzrost temperatury probówki. Sprawdź termometrem.
Przykład: Reakcja kwasu z zasadą, jak np. dodanie kwasu solnego (HCl) do wodorotlenku sodu (NaOH), powoduje znaczny wzrost temperatury.
Reakcje Endotermiczne
Pochłanianie ciepła, spadek temperatury. Probówka robi się zimna.
Przykład: Rozpuszczanie azotanu amonu (NH4NO3) w wodzie obniża temperaturę roztworu.
Zmiany Zapachu
Nowy zapach, inny od początkowych substratów. Ale ostrożnie, nie wszystko wąchamy!
Specyficzne Zapachy
Przykład: Powstawanie siarkowodoru (H2S) podczas reakcji siarczków z kwasami, charakteryzuje się zapachem zgniłych jaj.
Przykład: Wydzielanie amoniaku (NH3) podczas reakcji soli amonowych z mocnymi zasadami. Amoniak ma charakterystyczny, drażniący zapach.
Zmiany pH
Kwasowość lub zasadowość roztworu się zmienia. Użyj wskaźnika.
Wskaźniki pH
Papierek uniwersalny, fenoloftaleina, oranż metylowy – pokazują pH.
Przykład: Dodanie kwasu do roztworu zasadowego spowoduje obniżenie pH, co może być zasygnalizowane zmianą koloru wskaźnika, np. zmiana koloru fenoloftaleiny z malinowego na bezbarwny.
Miareczkowanie
Reakcja z odczynnikiem o znanym stężeniu. Obserwacja punktu końcowego.
Punkt Końcowy
Gwałtowna zmiana koloru w punkcie równoważnikowym.
Przykład: Miareczkowanie kwasu octowego (CH3COOH) roztworem wodorotlenku sodu (NaOH) z użyciem fenoloftaleiny jako wskaźnika. Punkt końcowy jest sygnalizowany pojawieniem się trwałego, bladoróżowego koloru.
Analiza Produktów
Identyfikacja powstałych substancji. Potwierdzenie reakcji.
Testy Chemiczne
Reakcje charakterystyczne dla określonych jonów lub związków.
Przykład: Wykrywanie obecności jonów chlorkowych (Cl-) poprzez dodanie roztworu azotanu srebra (AgNO3), co powoduje wytrącenie białego osadu AgCl.
Spektroskopia
Analiza widm absorpcyjnych i emisyjnych. Bardziej zaawansowane metody.
Przykład: Użycie spektroskopii UV-Vis do identyfikacji barwnych kompleksów metali poprzez analizę ich widma absorpcyjnego.
Podsumowanie
Obserwuj zmiany, analizuj wyniki. Wtedy wiesz, w której probówce zaszła reakcja.
Sprawdzaj kolor, temperaturę, zapach, pH. Testuj produkty. Kombinacja metod daje pewność.
Pamiętaj o bezpieczeństwie w laboratorium. Nie wąchaj nieznanych substancji bezpośrednio. Stosuj odpowiednie środki ochrony.
Bezpieczeństwo jest najważniejsze.