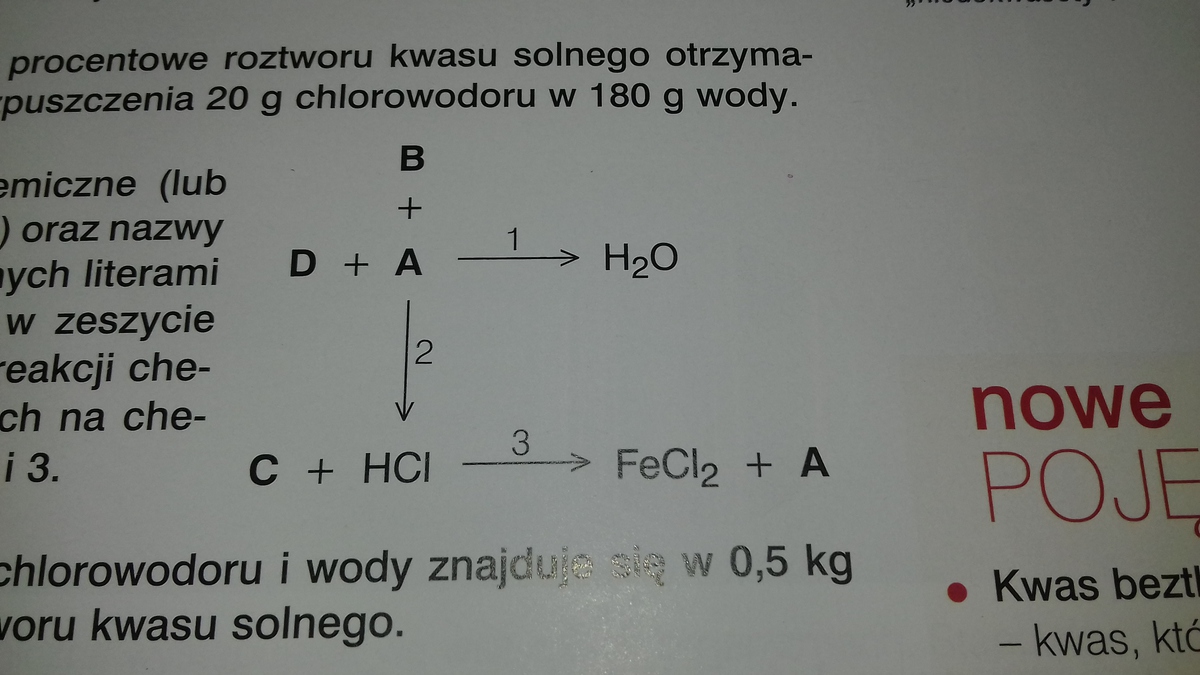
Rozpuszczalność substancji zależy od ich struktury chemicznej i interakcji z rozpuszczalnikiem.
Woda jest rozpuszczalnikiem polarnym.
Benzyna jest rozpuszczalnikiem niepolarnym.
Substancje Rozpuszczalne w Wodzie
Substancje polarne i jonowe zazwyczaj dobrze rozpuszczają się w wodzie.
Przykłady
Sól kuchenna (NaCl): To związek jonowy. Rozpuszcza się w wodzie, dysocjując na jony Na+ i Cl-.
Cukier (sacharoza): Zawiera wiele grup hydroksylowych (-OH), które tworzą wiązania wodorowe z wodą. To zwiększa jego rozpuszczalność.
Alkohol etylowy (etanol): Ma małą grupę niepolarną (etylową) i grupę polarną (-OH). Dlatego dobrze miesza się z wodą.
Kwas octowy (etanowy): Posiada polarną grupę karboksylową (-COOH), dzięki czemu dobrze rozpuszcza się w wodzie.
Amoniak (NH3): Jest gazem polarnym. Łatwo rozpuszcza się w wodzie, tworząc jony amonowe (NH4+) i wodorotlenowe (OH-).
Dlaczego te substancje się rozpuszczają?
Woda, jako rozpuszczalnik polarny, dobrze oddziałuje z innymi substancjami polarnymi lub jonowymi.
Te interakcje, takie jak wiązania wodorowe lub oddziaływania jon-dipol, kompensują energię potrzebną do rozerwania wiązań w samej substancji rozpuszczanej.
Substancje Rozpuszczalne w Benzynie
Benzyna, będąca mieszaniną węglowodorów, jest rozpuszczalnikiem niepolarnym.
Substancje niepolarne zazwyczaj dobrze rozpuszczają się w benzynie.
Przykłady
Woski: Są to długie łańcuchy węglowodorowe. Mają charakter niepolarny, dlatego dobrze rozpuszczają się w benzynie.
Oleje: Podobnie jak woski, oleje składają się głównie z węglowodorów. Są niepolarne i rozpuszczalne w benzynie.
Tłuszcze: Estry glicerolu i kwasów tłuszczowych. Są niepolarne i dobrze rozpuszczają się w rozpuszczalnikach organicznych, takich jak benzyna.
Polietylen (PE): To polimer węglowodorowy. Jest niepolarny i rozpuszcza się w benzynie, szczególnie podgrzanej.
Styropian (polistyren): Inny polimer węglowodorowy, który jest niepolarny i rozpuszczalny w benzynie.
Dlaczego te substancje się rozpuszczają?
Rozpuszczanie substancji niepolarnych w benzynie opiera się na oddziaływaniach sił London'a (sił van der Waalsa). Są to słabe oddziaływania międzycząsteczkowe.
Ponieważ zarówno benzyna, jak i substancje rozpuszczane są niepolarne, siły London'a są wystarczające, aby utrzymać je w roztworze.
Podsumowanie
Zasada "podobne rozpuszcza podobne" (like dissolves like) jest kluczowa w zrozumieniu rozpuszczalności.
Substancje polarne (jak sól i cukier) dobrze rozpuszczają się w rozpuszczalnikach polarnych (jak woda).
Substancje niepolarne (jak oleje i tłuszcze) dobrze rozpuszczają się w rozpuszczalnikach niepolarnych (jak benzyna).
Struktura chemiczna i siły międzycząsteczkowe decydują o rozpuszczalności danej substancji w konkretnym rozpuszczalniku.
Zastosowania Praktyczne
Zrozumienie rozpuszczalności ma wiele zastosowań praktycznych.
Przemysł spożywczy: Rozpuszczanie cukru w wodzie do słodzenia napojów.
Przemysł farmaceutyczny: Dobór odpowiedniego rozpuszczalnika do produkcji leków.
Czyszczenie: Użycie benzyny do usuwania plam z tłuszczu z ubrań.
Przemysł chemiczny: Rozpuszczalniki są używane do prowadzenia reakcji chemicznych.
Recykling: Niektóre polimery, takie jak styropian, można rozpuścić w benzynie i przetworzyć.
Znajomość zasad rozpuszczalności jest niezbędna w wielu dziedzinach nauki i techniki.