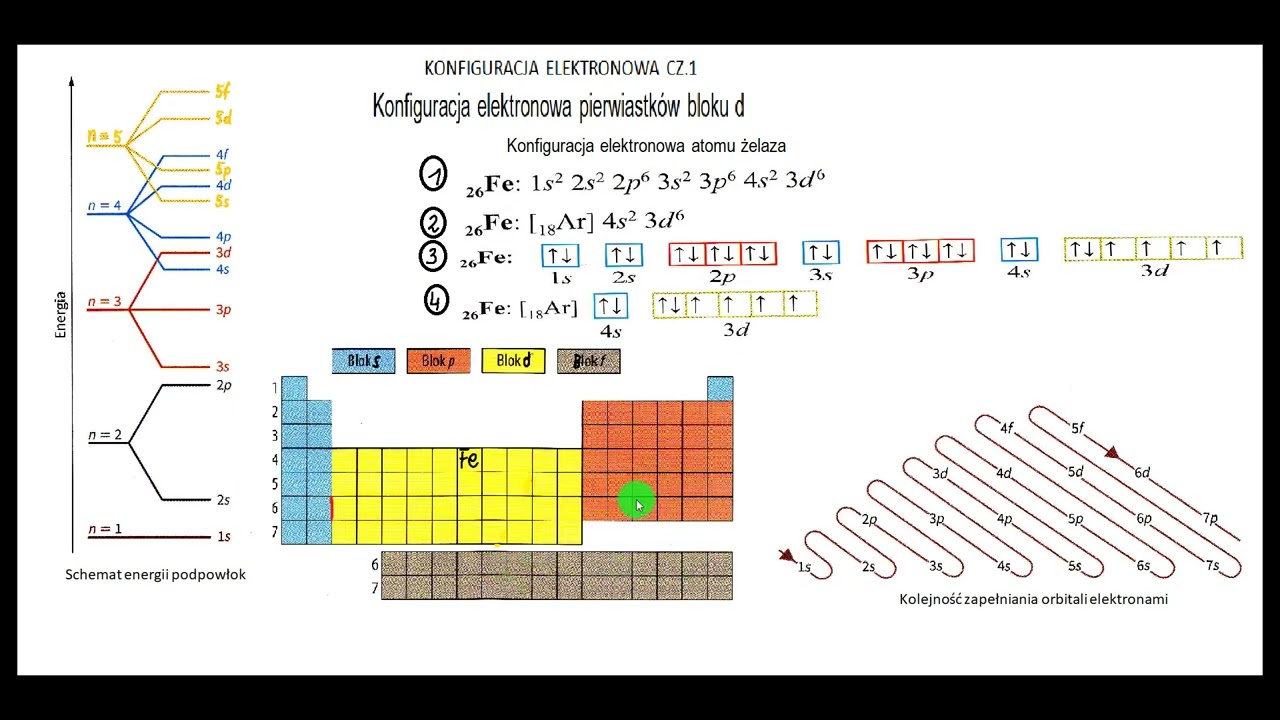
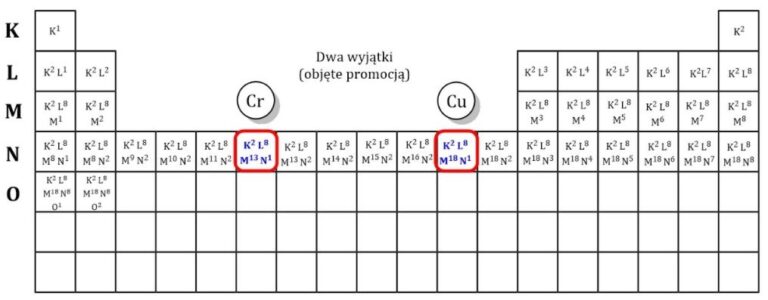
Dzień dobry! Spróbujmy zgłębić temat konfiguracji elektronowych i dążenia atomów do ich uzyskania.
Gaz Szlachetny - Wzorzec Stabilności
Który helowiec jest wzorcem? Neon. Jego konfiguracja elektronowa jest celem wielu atomów.
Dlaczego Neon?
Neon (Ne) ma konfigurację 1s² 2s² 2p⁶. Oznacza to osiem elektronów walencyjnych (oktet). To zapewnia mu wyjątkową stabilność.
Inne gazy szlachetne, takie jak argon, krypton, ksenon i radon, także posiadają oktety elektronowe na ostatniej powłoce. Jednakże neon jest często pierwszym przykładem, który uczniowie poznają po helu (który ma duplet elektronowy).
Jak Atomy Osiągają Konfigurację Neonu?
Atomy dążą do konfiguracji neonu poprzez różne procesy.
Wiązania Jonowe
Oddawanie lub przyjmowanie elektronów. Powstają jony.
Przykład: sód (Na) oddaje jeden elektron, stając się Na⁺. Chlor (Cl) przyjmuje jeden elektron, stając się Cl⁻. Obydwa jony mają konfigurację elektronową zbliżoną do neonu (dla Na⁺) lub argonu (dla Cl⁻), co jest stabilne. Chlorek sodu (NaCl) to sól kuchenna. Jest wynikiem połączenia jonów Na+ i Cl-.
Wiązania Kovalentne
Wspólne użytkowanie elektronów. Tworzenie cząsteczek.
Przykład: metan (CH₄). Atom węgla (C) ma cztery elektrony walencyjne. Potrzebuje jeszcze czterech, żeby osiągnąć oktet. Każdy z czterech atomów wodoru (H) dzieli z nim jeden elektron. Węgiel 'widzi' osiem elektronów wokół siebie (cztery własne i cztery od wodorów). Każdy atom wodoru widzi dwa elektrony (duplet), jak hel. To tworzy stabilną cząsteczkę metanu.
Jak Uczyć o Tym w Klasie?
Zacznij od podstaw. Wyjaśnij strukturę atomu (protony, neutrony, elektrony). Potem wprowadź pojęcie powłok elektronowych (K, L, M, itd.).
Model Bohra
Uproszczony model. Pomaga wizualizować elektrony na powłokach.
Tablica Mendelejewa
Pokaż, jak położenie pierwiastka w tablicy odnosi się do jego konfiguracji elektronowej.
Pierwiastki w jednej grupie mają podobną liczbę elektronów walencyjnych. Mają podobne właściwości chemiczne.
Przykłady z Życia Codziennego
Połączenia atomów. Woda (H₂O), dwutlenek węgla (CO₂).
Częste Błędy Uczniów
Myślą, że wszystkie atomy dążą *dokładnie* do konfiguracji neonu. Nieprawda! Dążą do konfiguracji najbliższego gazu szlachetnego.
Pomylenie wiązań jonowych i kowalencyjnych. Podkreśl różnicę w oddawaniu/przyjmowaniu a współdzieleniu elektronów.
Zrozumienie, że oktet jest *absolutnym* warunkiem stabilności. Wyjątki istnieją! (np. wodór z dupletem).
Uatrakcyjnienie Lekcji
Gry i Zabawy
Karty z pierwiastkami. Uczniowie dopasowują się w pary, tworząc związki.
Modele Atomów
Wykorzystanie piłeczek pingpongowych. Wyobrażają elektrony. Uczniowie tworzą modele cząsteczek.
Animacje
Filmy. Pokazują procesy tworzenia wiązań na poziomie atomowym.
Dyskusje
Pytania pobudzające myślenie. "Dlaczego gazy szlachetne są tak niereaktywne?".
Podsumowanie
Konfiguracja elektronowa. Ważna koncepcja. Rozumienie wiązań chemicznych. Neon jest dobrym przykładem. Pomaga w zrozumieniu dążenia atomów do stabilności. Używaj różnorodnych metod nauczania. Pomóż uczniom uniknąć typowych błędów.
Pamiętaj, aby dostosować poziom trudności do wieku i możliwości uczniów. Powodzenia!