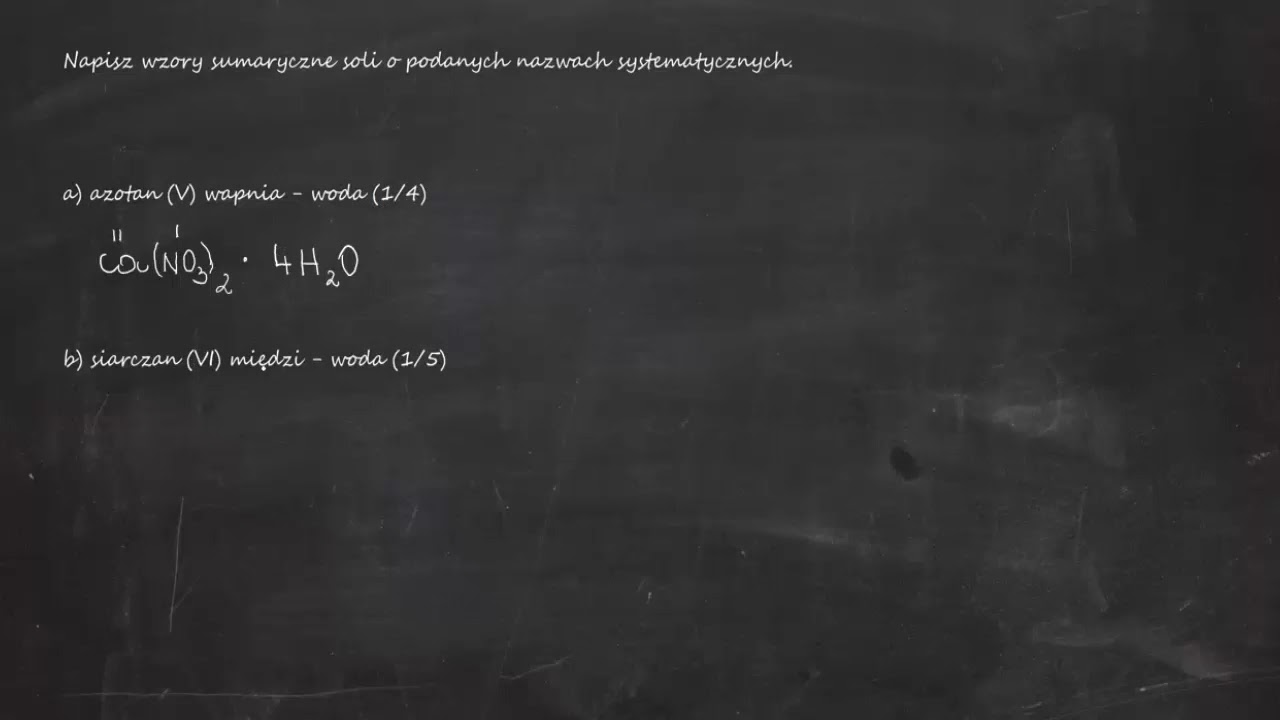Hej! Przygotowujesz się do sprawdzianu z chemii? Świetnie! Pomożemy Ci zrozumieć, jak pisać wzory sumaryczne soli na podstawie ich nazw systematycznych. Dasz radę! Zaczynamy?
Podstawy nazewnictwa soli
Nazwa systematyczna soli składa się z dwóch części: nazwy anionu (pochodzącej od kwasu) i nazwy kationu (pochodzącej od metalu). Brzmi skomplikowanie? Spokojnie, rozłożymy to na czynniki pierwsze.
Aniony – czyli to, co pochodzi od kwasów
Zacznijmy od anionów. Anion to jon o ładunku ujemnym. Pamiętaj, że nazwa anionu zależy od kwasu, z którego on powstał.
Kilka przykładów:
- Kwas solny (HCl) daje anion chlorkowy (Cl-)
- Kwas siarkowy(VI) (H2SO4) daje anion siarczanowy(VI) (SO42-)
- Kwas siarkowy(IV) (H2SO3) daje anion siarczanowy(IV) (SO32-)
- Kwas azotowy(V) (HNO3) daje anion azotanowy(V) (NO3-)
- Kwas węglowy (H2CO3) daje anion węglanowy (CO32-)
- Kwas fosforowy(V) (H3PO4) daje anion fosforanowy(V) (PO43-)
Zauważ, że w nazwach siarczanowy(VI), siarczanowy(IV), azotanowy(V) i fosforanowy(V) rzymskie cyfry w nawiasach oznaczają stopień utlenienia atomu centralnego (S, N lub P) w danym anionie. To bardzo ważne!
Kationy – czyli to, co pochodzi od metali
Teraz kationy. Kation to jon o ładunku dodatnim. Najczęściej są to metale.
Przykłady:
- Sód (Na) daje kation sodu (Na+)
- Potas (K) daje kation potasu (K+)
- Magnez (Mg) daje kation magnezu (Mg2+)
- Wapń (Ca) daje kation wapnia (Ca2+)
- Żelazo (Fe) może dawać kation żelaza(II) (Fe2+) lub żelaza(III) (Fe3+)
- Miedź (Cu) może dawać kation miedzi(I) (Cu+) lub miedzi(II) (Cu2+)
Podobnie jak w przypadku anionów, rzymskie cyfry w nawiasach (np. żelaza(II), miedzi(I)) oznaczają stopień utlenienia metalu. To kluczowe do poprawnego zapisu wzoru!
Piszemy wzory sumaryczne!
OK, teraz połączymy to wszystko w całość. Aby napisać wzór sumaryczny soli, musimy znać ładunki jonów (kationu i anionu) i dobrać ich liczbę tak, aby całkowity ładunek cząsteczki soli wynosił zero.
Krok 1: Zapisujemy symbol kationu i anionu z uwzględnieniem ich ładunków.
Krok 2: Dobieramy indeksy stechiometryczne (czyli te małe liczby na dole) tak, aby zrównoważyć ładunki.
Przykłady:
- Chlorek sodu: Sód (Na+), chlorek (Cl-). Potrzebujemy po jednym jonie każdego rodzaju, żeby ładunek był zerowy. Wzór: NaCl
- Siarczan(VI) potasu: Potas (K+), siarczan(VI) (SO42-). Potrzebujemy dwóch jonów potasu, żeby zrównoważyć ładunek -2 jonu siarczanowego(VI). Wzór: K2SO4
- Azotan(V) magnezu: Magnez (Mg2+), azotan(V) (NO3-). Potrzebujemy dwóch jonów azotanowych(V), żeby zrównoważyć ładunek +2 jonu magnezu. Wzór: Mg(NO3)2. Pamiętaj o nawiasach, jeśli anion zawiera więcej niż jeden atom!
- Fosforan(V) wapnia: Wapń (Ca2+), fosforan(V) (PO43-). Potrzebujemy trzech jonów wapnia (3 * +2 = +6) i dwóch jonów fosforanowych(V) (2 * -3 = -6). Wzór: Ca3(PO4)2
- Chlorek żelaza(II): Żelazo(II) (Fe2+), chlorek (Cl-). Potrzebujemy dwóch jonów chlorkowych. Wzór: FeCl2
- Siarczan(VI) żelaza(III): Żelazo(III) (Fe3+), siarczan(VI) (SO42-). Potrzebujemy dwóch jonów żelaza(III) i trzech jonów siarczanowych(VI). Wzór: Fe2(SO4)3
Kilka dodatkowych wskazówek
Pamiętaj o kilku ważnych rzeczach:
- Sprawdzaj stopnie utlenienia! Rzymska cyfra w nazwie soli mówi o stopniu utlenienia metalu lub atomu centralnego w anionie.
- Używaj nawiasów, gdy masz więcej niż jedną grupę atomów w anionie (np. (NO3)2).
- Uprość wzór, jeśli jest to możliwe (np. Mg2O2 można uprościć do MgO).
Przykładowe zadania i rozwiązania
Spróbujmy rozwiązać kilka zadań:
- Nazwa: Bromek miedzi(I) Rozwiązanie: Miedź(I) (Cu+), bromek (Br-). Wzór: CuBr
- Nazwa: Węglan glinu Rozwiązanie: Glin (Al3+), węglan (CO32-). Wzór: Al2(CO3)3
- Nazwa: Siarczan(IV) sodu Rozwiązanie: Sód (Na+), siarczan(IV) (SO32-). Wzór: Na2SO3
Podsumowanie
Gratulacje! Przeszliśmy przez cały proces pisania wzorów sumarycznych soli na podstawie nazw systematycznych. Pamiętaj, że kluczem jest:
- Zrozumienie, jak powstają nazwy anionów od kwasów.
- Zidentyfikowanie kationu i anionu w nazwie soli.
- Ustalenie ładunków kationu i anionu (stopień utlenienia!).
- Zrównoważenie ładunków, aby otrzymać obojętny wzór sumaryczny.
Ćwicz regularnie, a pisanie wzorów soli stanie się dla Ciebie pestką! Powodzenia na sprawdzianie! Wierzę w Ciebie!