Hej! Przygotowujesz się do egzaminu z chemii? Super! Razem przejdziemy przez wzory sumaryczne soli. Dziś na tapecie: chlorek amonu. Nie martw się, krok po kroku wszystko zrozumiesz.
Co to w ogóle jest chlorek amonu?
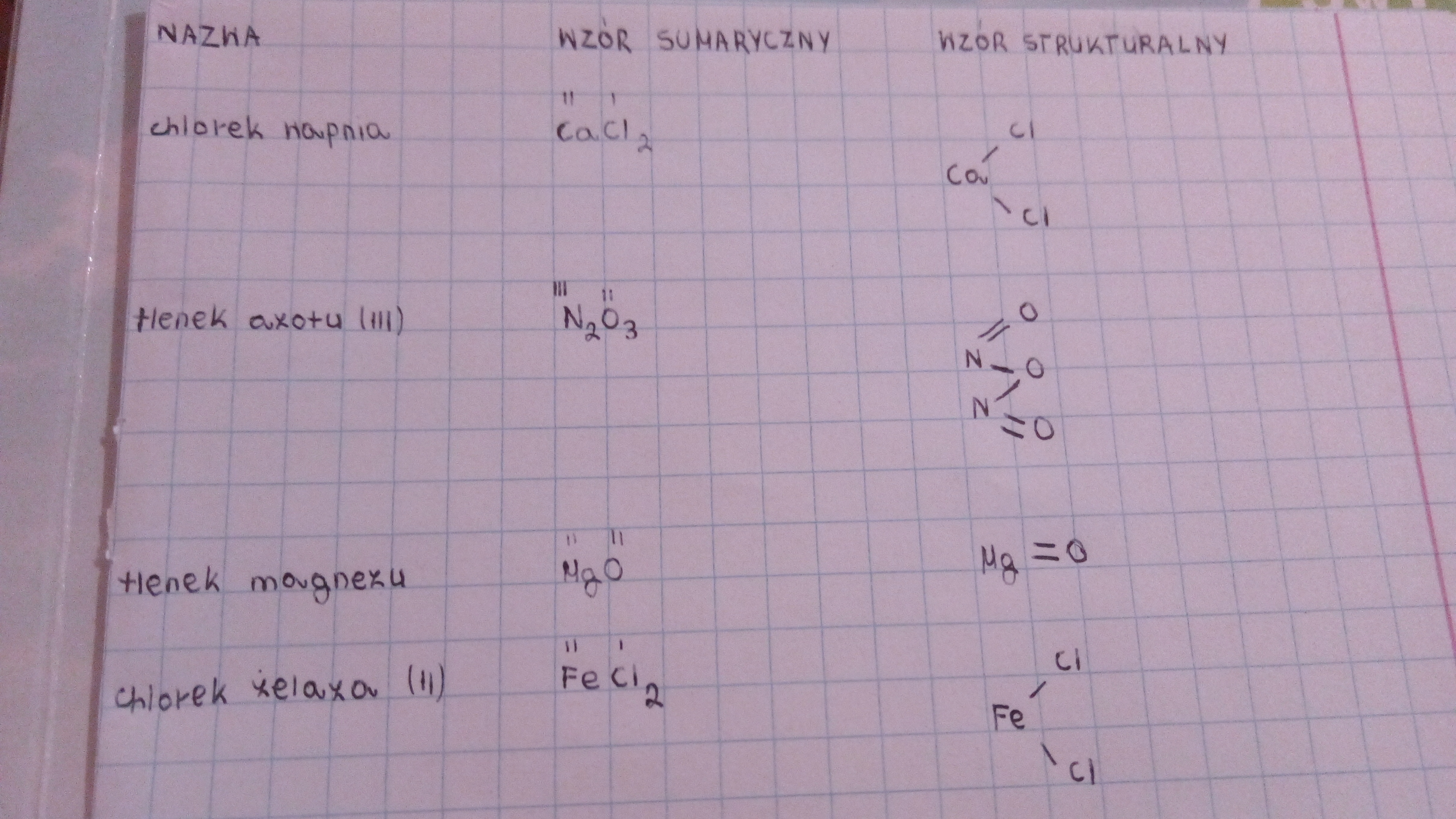
Chlorek amonu to sól. Powstaje, jak wszystkie sole, w wyniku reakcji kwasu z zasadą, albo reakcji metalu z kwasem, albo tlenku kwasowego z zasadą. W tym przypadku pochodzi od kwasu solnego i zasady amonowej.
Zanim napiszemy wzór, rozłóżmy nazwę na czynniki pierwsze. Chlorek mówi nam o obecności chloru. Amonu wskazuje na jon amonowy.
Jaki jest wzór jonu chlorkowego?
Jon chlorkowy to po prostu atom chloru, który przyjął jeden elektron. Jego symbol to Cl-.
A jaki jest wzór jonu amonowego?
Tutaj sprawa jest trochę bardziej skomplikowana. Jon amonowy to grupa atomów: jeden atom azotu i cztery atomy wodoru. Razem tworzą jon o wzorze NH4+.
Jak połączyć te jony?
Pamiętaj, że sole są elektrycznie obojętne. Ładunki dodatnie i ujemne muszą się równoważyć.
Jon amonowy ma ładunek +1. Jon chlorkowy ma ładunek -1. Widzisz już, co się stanie?
Jeden jon amonowy NH4+ potrzebuje jednego jonu chlorkowego Cl-, aby ładunki się zrównoważyły. +1 i -1 dają 0! Idealnie!
Wzór sumaryczny chlorku amonu
Mamy już wszystko, czego potrzebujemy. Wzór sumaryczny chlorku amonu to po prostu połączenie wzorów jonów:
NH4Cl
To cała filozofia! Widzisz, nie było takie straszne, prawda?
Przykłady innych soli
Spróbujmy teraz dla utrwalenia z innymi solami. Pomyślmy o siarczanie sodu.
Siarczan pochodzi od kwasu siarkowego. Jon siarczanowy to SO42-.
Sód ma symbol Na. Tworzy jon Na+.
Teraz równoważymy ładunki. Potrzebujemy dwóch jonów sodu Na+, aby zrównoważyć jeden jon siarczanowy SO42-. Dlatego wzór siarczanu sodu to Na2SO4.
A co z azotanem potasu?
Azotan pochodzi od kwasu azotowego. Jon azotanowy to NO3-.
Potas ma symbol K. Tworzy jon K+.
Tutaj ładunki też się równoważą jeden do jednego. Wzór azotanu potasu to KNO3.
Kilka wskazówek na koniec
- Zawsze zaczynaj od rozpoznania jonów, z których składa się sól.
- Pamiętaj o wartościowości jonów. To klucz do zrównoważenia ładunków.
- Sprawdzaj, czy suma ładunków dodatnich i ujemnych daje zero.
Pamiętaj! Ćwiczenie czyni mistrza! Im więcej soli spróbujesz nazwać i napisać ich wzory sumaryczne, tym lepiej będziesz to robić. Nie bój się pytać i szukać odpowiedzi. Jesteś na dobrej drodze do sukcesu!
Podsumowanie
Napisanie wzoru sumarycznego soli, takiej jak chlorek amonu, wymaga kilku kroków:
- Rozpoznanie jonów, z których składa się sól (w tym przypadku NH4+ i Cl-).
- Ustalenie wartościowości każdego jonu (+1 dla jonu amonowego i -1 dla jonu chlorkowego).
- Zrównoważenie ładunków, aby suma ładunków dodatnich i ujemnych wynosiła zero.
- Zapisanie wzoru sumarycznego, który pokazuje proporcje jonów w soli (NH4Cl).
Pamiętaj, praktyka czyni mistrza! Powodzenia na egzaminie!