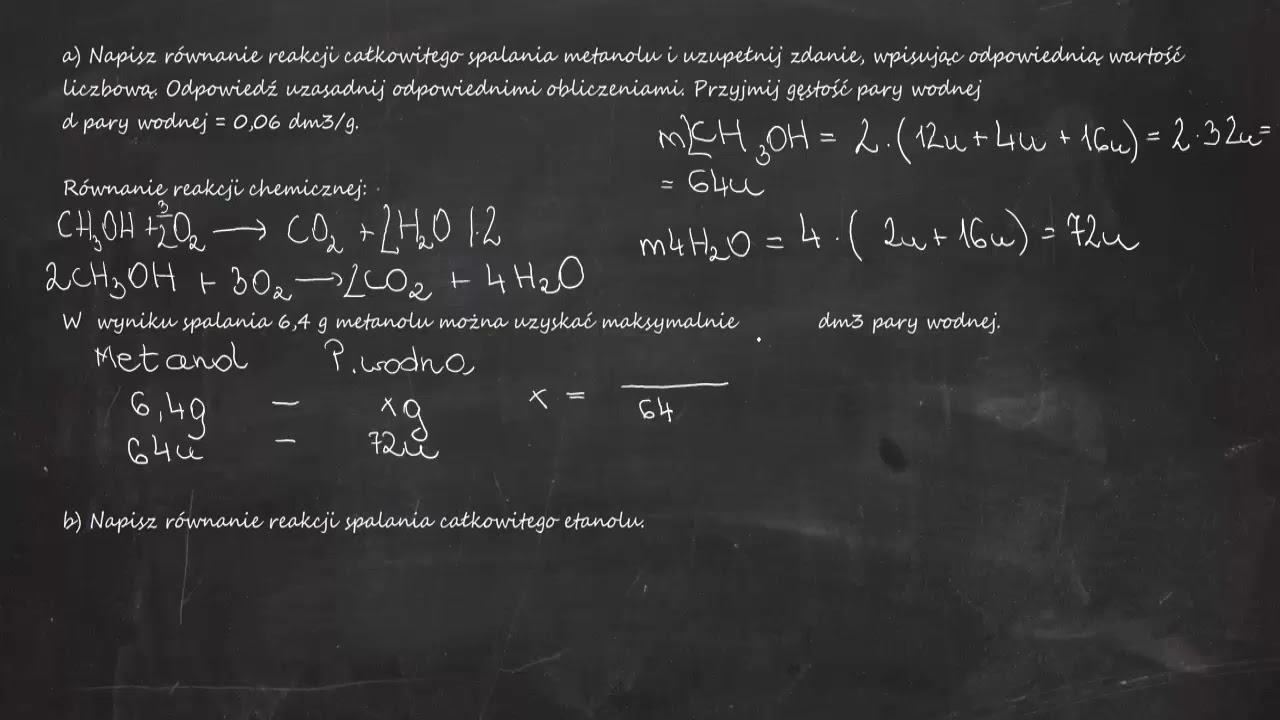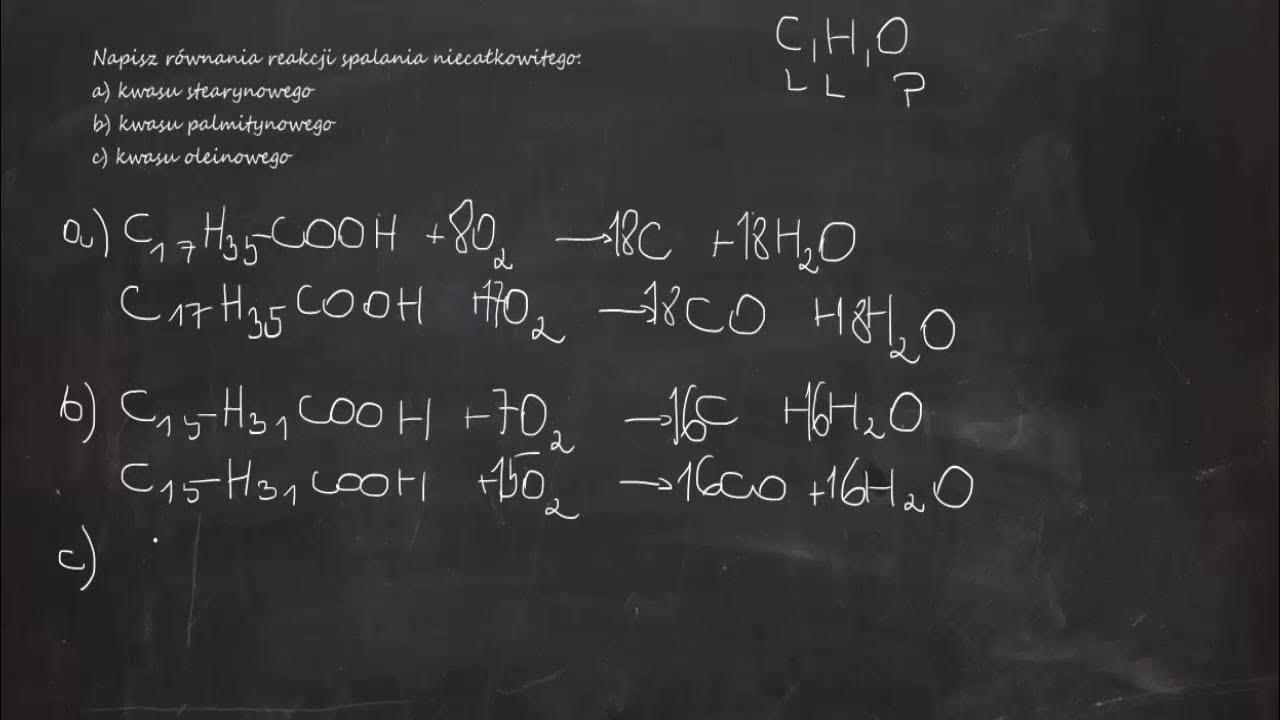Spalanie to proces chemiczny, w którym substancja reaguje z utleniaczem, zwykle tlenem, wydzielając ciepło i światło. W zależności od ilości dostępnego tlenu, spalanie może być całkowite lub niecałkowite.
Spalanie Całkowite vs. Niecałkowite
Spalanie całkowite zachodzi, gdy tlenu jest wystarczająco dużo. Powstają wtedy produkty w pełni utlenione, np. w przypadku związków organicznych – dwutlenek węgla (CO2) i woda (H2O).
Spalanie niecałkowite ma miejsce, gdy tlenu jest za mało. Wtedy powstają produkty częściowo utlenione, np. tlenek węgla (CO), węgiel (C) – sadza, a także woda (H2O).
Metanol, czyli alkohol metylowy (CH3OH), jest związkiem organicznym. Może ulegać zarówno spalaniu całkowitemu, jak i niecałkowitemu.
Spalanie Całkowite Metanolu
Równanie reakcji spalania całkowitego metanolu wygląda następująco:
2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
W tym przypadku, metanol reaguje z tlenem, tworząc dwutlenek węgla i wodę. Spalanie całkowite jest najbardziej efektywne energetycznie.
Spalanie Niecałkowite Metanolu – Równania Reakcji
Teraz przejdziemy do omawiania spalania niecałkowitego metanolu. Z braku wystarczającej ilości tlenu, reakcja przebiega różnymi ścieżkami, prowadząc do powstania różnych produktów.
Powstawanie Tlenku Węgla (CO)
Jednym z produktów spalania niecałkowitego jest tlenek węgla, czyli czad. Jest to gaz silnie trujący. Równanie reakcji wygląda następująco:
2 CH3OH + 2 O2 → 2 CO + 4 H2O
W tej reakcji, zamiast dwutlenku węgla, powstaje tlenek węgla. Jest to mniej pożądany produkt, zarówno ze względu na jego toksyczność, jak i mniejszą efektywność energetyczną procesu.
Powstawanie Węgla (C) – Sadzy
Innym produktem spalania niecałkowitego jest węgiel, czyli sadza. Sadza to drobne cząstki węgla, które powstają, gdy spalanie jest bardzo nieefektywne. Równanie reakcji:
2 CH3OH + O2 → 2 C + 4 H2O
Tutaj metanol reaguje z bardzo małą ilością tlenu, tworząc węgiel w postaci stałej oraz wodę. Powstawanie sadzy jest bardzo niekorzystne.
Możliwe Równoczesne Reakcje
W praktyce, spalanie niecałkowite metanolu rzadko kiedy przebiega tylko jedną ścieżką. Często dochodzi do jednoczesnego powstawania tlenku węgla, węgla (sadzy) i dwutlenku węgla, w różnych proporcjach, w zależności od warunków. Możemy zapisać to w sposób ogólny:
CH3OH + O2 → x CO2 + y CO + z C + 2 H2O
Gdzie x, y, i z reprezentują odpowiednie współczynniki stechiometryczne, które zależą od konkretnych warunków reakcji.
Czynniki Wpływające na Rodzaj Spalania
Kilka czynników wpływa na to, czy spalanie metanolu będzie całkowite, czy niecałkowite:
- Dostępność tlenu: Im więcej tlenu, tym bardziej prawdopodobne jest spalanie całkowite.
- Temperatura: Wyższa temperatura sprzyja spalaniu całkowitemu.
- Mieszanie: Dobre wymieszanie paliwa i tlenu również poprawia efektywność spalania.
- Konstrukcja palnika/pieca: Specjalne konstrukcje mogą zapewnić lepszy dostęp tlenu i wyższą temperaturę.
Praktyczne Zastosowania i Implikacje
Zrozumienie reakcji spalania metanolu (i innych paliw) ma kluczowe znaczenie w wielu dziedzinach:
- Inżynieria: Projektowanie silników spalinowych i systemów grzewczych, które minimalizują emisję szkodliwych substancji.
- Ochrona środowiska: Ograniczanie zanieczyszczeń powietrza, zwłaszcza tlenku węgla i sadzy.
- Bezpieczeństwo: Zapobieganie zatruciom tlenkiem węgla, które mogą być śmiertelne.
- Chemia przemysłowa: Optymalizacja procesów spalania w różnych gałęziach przemysłu.
Kontrolowanie warunków spalania pozwala na minimalizowanie powstawania szkodliwych produktów i zwiększanie efektywności energetycznej procesów spalania.
Spalanie niecałkowite metanolu (i innych paliw) to skomplikowany proces. Zrozumienie równań reakcji, czynników wpływających na rodzaj spalania oraz implikacji praktycznych, pozwala na lepsze projektowanie i optymalizację procesów technologicznych, minimalizując negatywny wpływ na środowisko i zdrowie ludzkie.