Chemia bywa trudna, ale zapisywanie reakcji chemicznych wcale nie musi takie być. Spróbujmy to uprościć! Wyobraź sobie, że masz przepis na ciasto. Reakcja chemiczna to taki przepis, tylko zamiast mąki i cukru masz substancje chemiczne, a zamiast piekarnika - warunki reakcji.
Podstawowe pojęcia
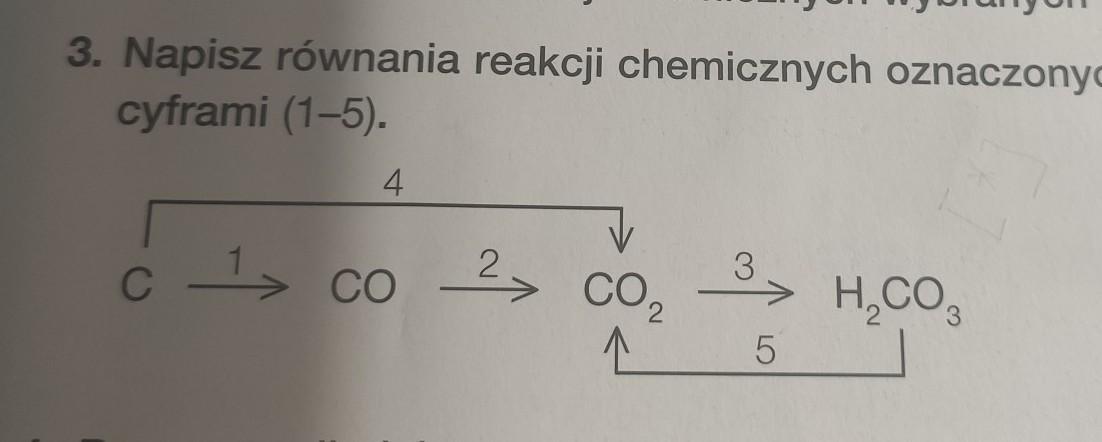
Zanim przejdziemy do pisania równań reakcji oznaczonych cyframi 1 i 5, omówmy kilka kluczowych pojęć. Ułatwi to zrozumienie dalszej części.
Substrat i produkt
Substrat to substancja, która *reaguje* w reakcji chemicznej. Można powiedzieć, że to *składnik* naszego ciasta. Produkt to substancja, która *powstaje* w wyniku reakcji chemicznej. To nasze gotowe ciasto! Na przykład, jeśli palimy drewno, to drewno (głównie celuloza) jest substratem, a popiół, dwutlenek węgla i woda są produktami.
Równanie reakcji
Równanie reakcji to zapis, który pokazuje, co reaguje i co powstaje. Zapisujemy substraty po lewej stronie strzałki, a produkty po prawej. Strzałka oznacza "reaguje, dając" lub "przekształca się w". Na przykład:
Substrat → Produkt
Jeśli mamy więcej niż jeden substrat lub produkt, oddzielamy je znakiem plus (+).
Substrat 1 + Substrat 2 → Produkt 1 + Produkt 2
Współczynniki stechiometryczne
To bardzo ważne! Reakcja chemiczna musi być *zbilansowana*. Oznacza to, że liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania. Do tego używamy współczynników stechiometrycznych. To liczby, które stawiamy przed wzorami chemicznymi, żeby zbilansować równanie. Wyobraź sobie, że masz przepis na ciasto, który wymaga dwóch jajek. Współczynnik stechiometryczny dla jajek to 2.
Przykłady z życia wzięte
Spójrzmy na kilka prostych przykładów, zanim przejdziemy do bardziej skomplikowanych reakcji.
Spalanie metanu
Metan (CH4) to główny składnik gazu ziemnego. Spalanie metanu to reakcja z tlenem (O2), w wyniku której powstaje dwutlenek węgla (CO2) i woda (H2O).
Niezbilansowane równanie: CH4 + O2 → CO2 + H2O
Zbilansowane równanie: CH4 + 2O2 → CO2 + 2H2O
Zwróć uwagę, że po obu stronach równania mamy: 1 atom węgla (C), 4 atomy wodoru (H) i 4 atomy tlenu (O).
Rdza
Rdza to tlenek żelaza (Fe2O3). Powstaje w wyniku reakcji żelaza (Fe) z tlenem (O2) w obecności wody.
Niezbilansowane równanie: Fe + O2 → Fe2O3
Zbilansowane równanie: 4Fe + 3O2 → 2Fe2O3
Teraz po obu stronach mamy: 4 atomy żelaza (Fe) i 6 atomów tlenu (O).
Piszemy równania reakcji - krok po kroku
Ok, mamy podstawy. Teraz przejdźmy do pisania równań reakcji, krok po kroku:
- Określ substraty i produkty. Dowiedz się, co reaguje i co powstaje. Często jest to podane w treści zadania.
- Zapisz niezbilansowane równanie reakcji. Użyj wzorów chemicznych substratów i produktów.
- Zbilansuj równanie. Dobierz odpowiednie współczynniki stechiometryczne, tak aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. Zacznij od pierwiastków, które występują tylko w jednym substracie i jednym produkcie.
- Sprawdź bilans. Upewnij się, że równanie jest rzeczywiście zbilansowane.
Równania reakcji oznaczone cyframi 1 i 5 (przykładowe)
Aby pomóc Ci zrozumieć, jak to działa w praktyce, spróbujmy napisać równania reakcji oznaczonych cyframi 1 i 5, zakładając, że mamy następujący schemat reakcji (to tylko przykłady, ponieważ nie znamy Twojego konkretnego schematu):
A → (1) B + C
D + E → (5) F
Reakcja 1: A → B + C
Załóżmy, że A to węglan wapnia (CaCO3), B to tlenek wapnia (CaO), a C to dwutlenek węgla (CO2). Ta reakcja to rozkład węglanu wapnia pod wpływem temperatury (kalcynacja).
Węglan wapnia (CaCO3) jest używany w budownictwie (np. do produkcji cementu) i w rolnictwie (do odkwaszania gleby). Tlenek wapnia (CaO), znany jako wapno palone, również znajduje zastosowanie w budownictwie i rolnictwie.
- Substraty i produkty: Substrat to CaCO3, produkty to CaO i CO2.
- Niezbilansowane równanie: CaCO3 → CaO + CO2
- Zbilansowane równanie: CaCO3 → CaO + CO2
- Sprawdzenie bilansu:
- Ca: 1 atom po lewej, 1 atom po prawej
- C: 1 atom po lewej, 1 atom po prawej
- O: 3 atomy po lewej, 3 atomy po prawej
Równanie jest już zbilansowane! Nie musieliśmy używać współczynników stechiometrycznych innych niż 1. To reakcja rozkładu, w której jeden związek rozpada się na dwa lub więcej innych.
Reakcja 5: D + E → F
Załóżmy, że D to wodór (H2), E to tlen (O2), a F to woda (H2O). To reakcja łączenia się wodoru z tlenem, czyli spalanie wodoru. Ta reakcja zachodzi w ogniwach paliwowych.
- Substraty i produkty: Substraty to H2 i O2, produkt to H2O.
- Niezbilansowane równanie: H2 + O2 → H2O
- Zbilansowane równanie: 2H2 + O2 → 2H2O
- Sprawdzenie bilansu:
- H: 4 atomy po lewej, 4 atomy po prawej
- O: 2 atomy po lewej, 2 atomy po prawej
W tym przypadku musieliśmy dodać współczynniki stechiometryczne: 2 przed H2 i 2 przed H2O, aby zbilansować atomy wodoru i tlenu. To reakcja syntezy, w której dwa lub więcej związków łączą się w jeden.
Kilka dodatkowych wskazówek
- Zawsze sprawdzaj, czy równanie jest zbilansowane. To kluczowe!
- Pamiętaj o stanach skupienia (s) – stały, (l) – ciekły, (g) – gazowy, (aq) – roztwór wodny. Możesz je zapisać w nawiasach obok wzorów chemicznych, np. H2O(l).
- Ćwicz, ćwicz i jeszcze raz ćwicz! Im więcej równań napiszesz, tym łatwiej Ci to będzie przychodzić.
Mam nadzieję, że to wszystko pomogło Ci zrozumieć, jak pisać równania reakcji chemicznych. Pamiętaj, że chemia może być fascynująca, jeśli podejdziesz do niej krok po kroku i zrozumiesz podstawowe zasady! Powodzenia!