Cześć! Zastanawiasz się, jak powstają wodorotlenki? No to zaczynamy!
Wodorotlenki: Fabryka zasad
Wyobraź sobie wodorotlenek jako fabrykę zasad. Zasady to związki, które neutralizują kwasy. Wodorotlenki to jedna z najważniejszych grup tych związków.
Wodorotlenek to związek chemiczny. Składa się z metalu i grupy wodorotlenowej (OH-).
Popatrz na wzór ogólny: M(OH)n. "M" to metal, a "(OH)" to grupa wodorotlenowa. "n" to liczba grup wodorotlenowych. Zależy od wartościowości metalu.
Metoda 1: Metal + Woda
Niektóre metale reagują bezpośrednio z wodą. Powstaje wodorotlenek i wodór. Pamiętaj: to dotyczy głównie metali alkalicznych (pierwsza grupa układu okresowego) i metali ziem alkalicznych (druga grupa układu okresowego).
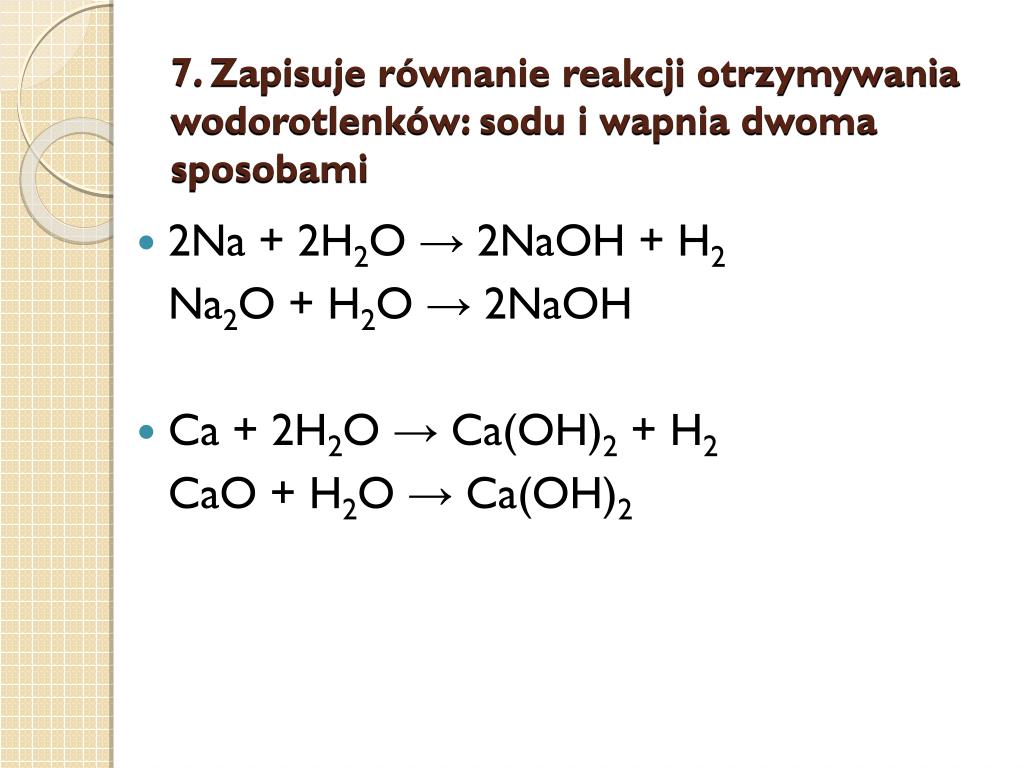
Wyobraź sobie: wrzucasz mały kawałek sodu (Na) do wody. Co się dzieje? Sód zaczyna "tańczyć" po powierzchni wody. Wydziela się ciepło. Powstaje wodorotlenek sodu (NaOH) i wodór (H2).
Równanie reakcji:
2Na + 2H2O → 2NaOH + H2
Podobnie reaguje potas (K). Reakcja jest jeszcze bardziej gwałtowna!
2K + 2H2O → 2KOH + H2
Wapń (Ca) reaguje nieco wolniej. Powstaje wodorotlenek wapnia (Ca(OH)2).
Ca + 2H2O → Ca(OH)2 + H2
Pomyśl o tym jak o małym wybuchu kontrolowanym przez chemika. Bezpieczeństwo przede wszystkim!
Metoda 2: Tlenek metalu + Woda
Tlenki metali, zwłaszcza te metali alkalicznych i ziem alkalicznych, też mogą reagować z wodą. Tworzą wodorotlenki.
Wyobraź sobie tlenek sodu (Na2O). To biały proszek. Dodajesz go do wody.
Powstaje wodorotlenek sodu (NaOH).
Równanie reakcji:
Na2O + H2O → 2NaOH
Tlenek wapnia (CaO), znany jako wapno palone, reaguje z wodą. Proces nazywamy gaszeniem wapna.
CaO + H2O → Ca(OH)2
Produktem jest wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone. Używa się go w budownictwie i rolnictwie.
Pamiętaj: nie wszystkie tlenki metali reagują z wodą. Zależy to od ich właściwości.
Metoda 3: Reakcja wymiany
Możemy otrzymać wodorotlenek w reakcji wymiany. Reaguje rozpuszczalna sól metalu z rozpuszczalnym wodorotlenkiem.
Wyobraź sobie: masz roztwór chlorku żelaza(III) (FeCl3). Dodajesz do niego roztwór wodorotlenku sodu (NaOH).
Co się dzieje? Powstaje wodorotlenek żelaza(III) (Fe(OH)3) w postaci brunatnego osadu i chlorek sodu (NaCl).
Równanie reakcji:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Strzałka w dół (↓) oznacza, że produkt wytrąca się z roztworu w postaci osadu.
Inny przykład: siarczan miedzi(II) (CuSO4) reaguje z wodorotlenkiem potasu (KOH).
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Powstaje wodorotlenek miedzi(II) (Cu(OH)2), który ma postać niebieskiego osadu, i siarczan potasu (K2SO4).
Ta metoda jest bardzo uniwersalna. Pozwala otrzymać wiele różnych wodorotlenków metali.
Praktyczne zastosowania
Gdzie spotykamy wodorotlenki w życiu codziennym? Bardzo często!
Wodorotlenek sodu (NaOH), czyli soda kaustyczna, używany jest do produkcji mydła, papieru i środków czyszczących.
Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone, stosowany jest w budownictwie, rolnictwie i do oczyszczania ścieków.
Wodorotlenek magnezu (Mg(OH)2), czyli mleczko magnezjowe, używany jest jako lek zobojętniający kwas żołądkowy.
Jak widzisz, wodorotlenki są bardzo ważne i przydatne!
Podsumowanie
Otrzymywanie wodorotlenków może odbywać się na różne sposoby:
- Metal + Woda
- Tlenek metalu + Woda
- Reakcja wymiany
Wybór metody zależy od właściwości metalu i dostępnych substratów.
Pamiętaj o bezpieczeństwie! Praca z chemikaliami wymaga ostrożności i wiedzy.
Teraz już wiesz, jak powstają wodorotlenki. Powodzenia w dalszej nauce chemii!