Chemia może wydawać się skomplikowana, ale tak naprawdę opiera się na kilku prostych zasadach. Jedną z najważniejszych jest zrozumienie, jak łączą się ze sobą atomy i jak to połączenie opisują równania reakcji chemicznych. Przygotuj się na fascynującą podróż do świata mikroskopijnych cząstek!
Łączenie Atomów: Dlaczego i Jak?
Wszystko, co widzisz i dotykasz, zbudowane jest z atomów. Atomy to podstawowe jednostki materii, składające się z protonów, neutronów i elektronów. To właśnie elektrony odgrywają kluczową rolę w łączeniu się atomów ze sobą.
Atomy łączą się, żeby stać się bardziej stabilnymi. Wyobraź sobie, że atom to osoba, która czuje się samotna i szuka towarzystwa. Atomy chcą mieć pełną powłokę elektronową, a łączenie się z innymi atomami często im to umożliwia. To jak znalezienie brakującego elementu układanki!
Rodzaje Wiązań Chemicznych
Istnieją różne rodzaje wiązań chemicznych, ale dwa z nich są najważniejsze: wiązania kowalencyjne i jonowe. Zrozumienie różnicy między nimi jest kluczowe do zrozumienia, jak zachodzą reakcje chemiczne. Przyjrzyjmy się im bliżej.
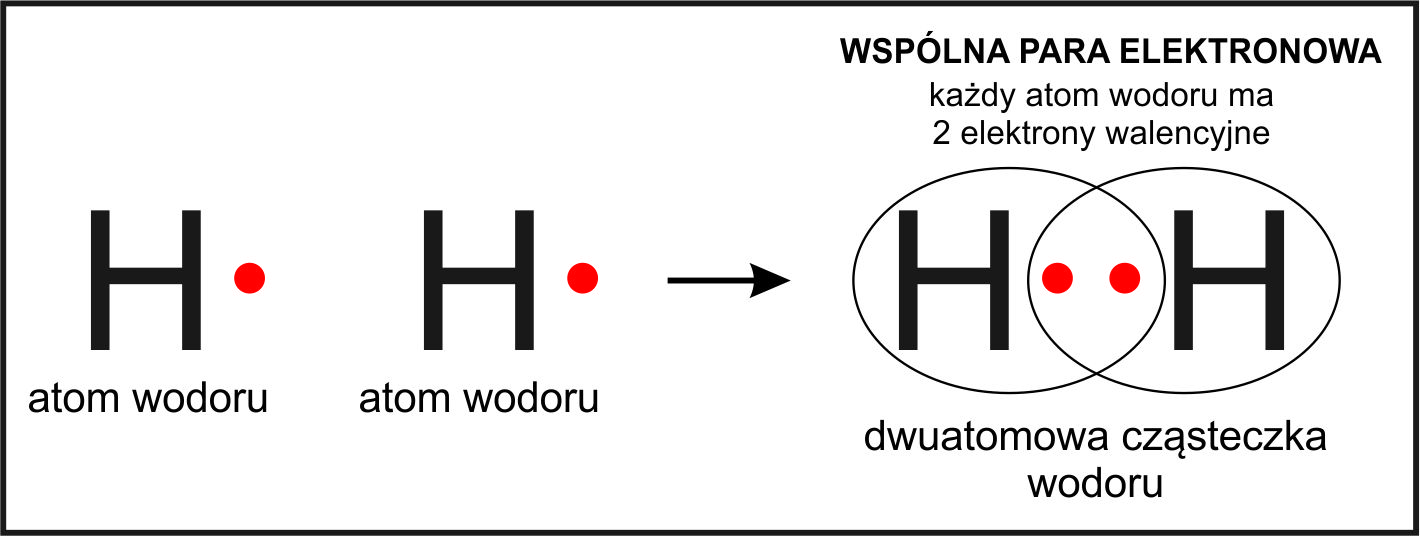
Wiązanie kowalencyjne powstaje, gdy atomy dzielą się elektronami. To jak wspólne korzystanie z zabawki przez dwoje dzieci. Żaden z atomów nie traci elektronów, ale oba zyskują dostęp do większej liczby elektronów, co czyni je bardziej stabilnymi. Przykładem związku z wiązaniami kowalencyjnymi jest woda (H2O), gdzie atomy wodoru dzielą się elektronami z atomem tlenu.
Wiązanie jonowe powstaje, gdy atom oddaje elektron innemu atomowi. To jak przekazanie zabawki innemu dziecku na stałe. Atom, który oddaje elektron, staje się dodatnio naładowanym jonem (kationem), a atom, który przyjmuje elektron, staje się ujemnie naładowanym jonem (anionem). Te przeciwne ładunki przyciągają się, tworząc wiązanie jonowe. Przykładem jest chlorek sodu (NaCl), czyli sól kuchenna, gdzie atom sodu oddaje elektron atomowi chloru.
Przykłady z Życia Codziennego
Pomyśl o wodzie (H2O). Dwa atomy wodoru dzielą się elektronami z atomem tlenu, tworząc stabilną cząsteczkę wody. Dzięki temu możemy pić wodę i korzystać z niej na wiele innych sposobów. Wiązania kowalencyjne w wodzie pozwalają jej na utrzymanie swojej struktury.
Inny przykład to sól kuchenna (NaCl). Atomy sodu i chloru tworzą wiązanie jonowe, co pozwala na powstanie kryształów soli. Sól dodaje smaku naszym potrawom i jest niezbędna do funkcjonowania naszego organizmu. Wiązania jonowe w soli są bardzo silne, dlatego sól jest substancją stałą w temperaturze pokojowej.
Równania Reakcji Chemicznych: Język Chemików
Równania reakcji chemicznych to sposób na opisanie, co się dzieje podczas reakcji chemicznej. To jak przepis na ciasto, tylko zamiast składników masz atomy i cząsteczki. Równania pozwalają nam przewidzieć, jakie produkty powstaną w wyniku reakcji i w jakich ilościach.
Równanie reakcji chemicznej składa się z dwóch stron, oddzielonych strzałką. Po lewej stronie znajdują się substraty, czyli substancje, które reagują ze sobą. Po prawej stronie znajdują się produkty, czyli substancje, które powstają w wyniku reakcji. Strzałka wskazuje kierunek reakcji.
Na przykład, reakcja spalania metanu (CH4) w tlenie (O2) daje dwutlenek węgla (CO2) i wodę (H2O). Równanie tej reakcji wygląda następująco: CH4 + 2O2 → CO2 + 2H2O. Zwróć uwagę, że przed niektórymi cząsteczkami znajdują się liczby. To są współczynniki stechiometryczne.
Współczynniki Stechiometryczne: Równoważenie Równań
Współczynniki stechiometryczne wskazują, ile cząsteczek każdej substancji bierze udział w reakcji. Równanie reakcji musi być zrównoważone, co oznacza, że liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania. To jak upewnienie się, że przepis na ciasto zawiera odpowiednią ilość każdego składnika.
Równoważenie równań polega na dodawaniu odpowiednich współczynników przed cząsteczkami, tak aby liczba atomów każdego pierwiastka była taka sama po obu stronach. W przykładzie spalania metanu, potrzebujemy dwóch cząsteczek tlenu, żeby zrównoważyć liczbę atomów tlenu po obu stronach równania. Potrzebujemy także dwóch cząsteczek wody, aby zrównoważyć liczbę atomów wodoru.
Spróbujmy zrównoważyć prostsze równanie: H2 + O2 → H2O. Po lewej stronie mamy dwa atomy wodoru i dwa atomy tlenu. Po prawej stronie mamy dwa atomy wodoru i jeden atom tlenu. Żeby zrównoważyć liczbę atomów tlenu, dodajemy współczynnik 2 przed H2O: H2 + O2 → 2H2O. Teraz mamy dwa atomy wodoru po lewej stronie i cztery po prawej. Dodajemy współczynnik 2 przed H2: 2H2 + O2 → 2H2O. Równanie jest teraz zrównoważone!
Przykłady Równań Reakcji Chemicznych
Fotosynteza: 6CO2 + 6H2O → C6H12O6 + 6O2. Rośliny wykorzystują dwutlenek węgla i wodę, żeby wytworzyć glukozę i tlen. To dzięki fotosyntezie mamy tlen w atmosferze.
Oddychanie komórkowe: C6H12O6 + 6O2 → 6CO2 + 6H2O. Nasze komórki wykorzystują glukozę i tlen, żeby wytworzyć energię, dwutlenek węgla i wodę. To dzięki oddychaniu komórkowemu mamy energię do funkcjonowania.
Spalanie węgla: C + O2 → CO2. Węgiel reaguje z tlenem, dając dwutlenek węgla. To prosta reakcja, która zachodzi podczas spalania węgla w piecu.
Podsumowanie
Łączenie się atomów i równania reakcji chemicznych to fundamentalne pojęcia w chemii. Zrozumienie, jak atomy łączą się ze sobą i jak opisywać te połączenia za pomocą równań, otwiera drzwi do zrozumienia świata chemii. Pamiętaj, że chemia jest wszędzie wokół nas, w każdym oddechu, każdym łyku wody i każdym kroku, który stawiamy. Teraz masz solidne podstawy, żeby kontynuować swoją przygodę z chemią!