Cześć! Zastanawiasz się, jak rozszyfrować te dziwne cyferki przy symbolach pierwiastków? Bez obaw! To nic trudnego, nauczymy się sprawdzać wartościowość! Wyobraź sobie wartościowość jako "ręce" pierwiastka – ile innych pierwiastków może "złapać".
Co to jest wartościowość?
Wartościowość to liczba wiązań chemicznych, które atom danego pierwiastka może utworzyć z innymi atomami. Pomyśl o tym jak o zdolności pierwiastka do łączenia się z innymi.
Wartościowość zapisujemy cyframi rzymskimi: I, II, III, IV, V, VI, VII, VIII. Widzisz te cyfry? Zaraz zobaczysz, jak je wykorzystać.
Prosta analogia: Wyobraź sobie, że atomy to klocki LEGO. Niektóre klocki mają jedno połączenie, inne dwa, a jeszcze inne więcej. Wartościowość to liczba tych połączeń.
Jak sprawdzić wartościowość pierwiastka?
Istnieją różne sposoby, aby określić wartościowość. Pokażemy kilka najpopularniejszych.
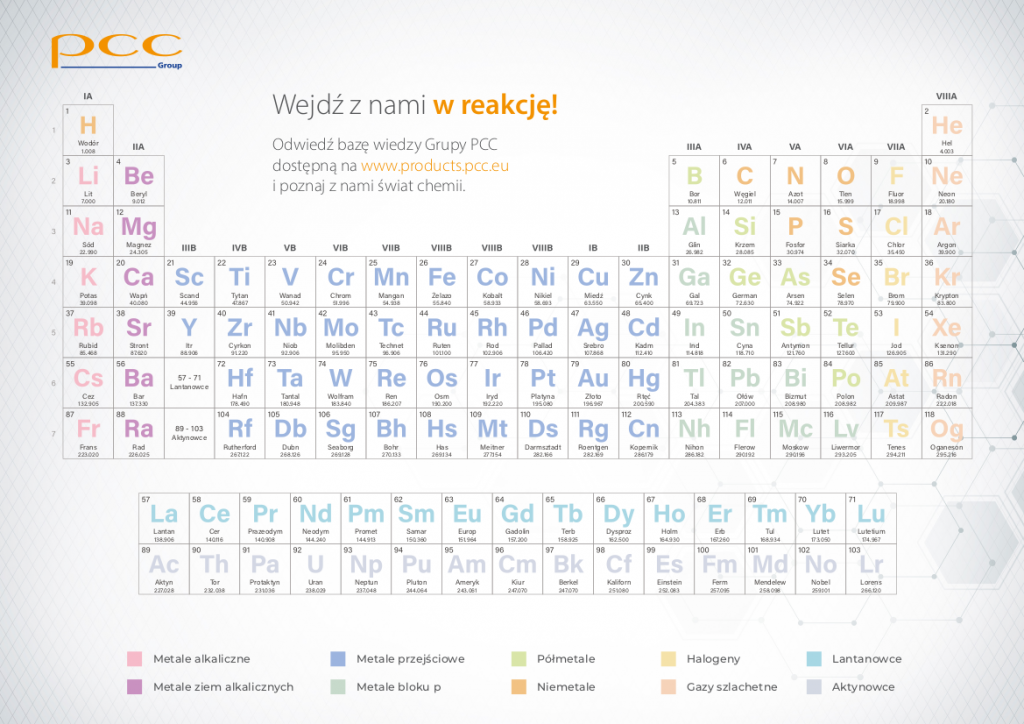
1. Korzystanie z układu okresowego pierwiastków.
Układ okresowy to twój najlepszy przyjaciel! Wartościowość wielu pierwiastków (szczególnie tych z grup 1, 2 i 13-17) można łatwo odczytać z układu okresowego.
Grupa 1 (np. lit, sód, potas): Te pierwiastki mają wartościowość I. Pamiętaj: jeden "ręka" do chwytania.
Grupa 2 (np. magnez, wapń): Te pierwiastki mają wartościowość II. Dwie "ręce" do trzymania.
Grupa 13 (np. glin): Zazwyczaj ma wartościowość III. Trzy "ręce" – zaczyna się robić ciekawie!
Grupa 16 (np. tlen, siarka): Często mają wartościowość II. Dwa "ręce" – tak jak w grupie 2.
Grupa 17 (np. fluor, chlor, brom): Często mają wartościowość I. Jeden "ręka" – tak jak w grupie 1.
Pamiętaj! To uproszczenie. Niektóre pierwiastki mogą mieć różne wartościowości. O tym za chwilę.
Wyobraź sobie układ okresowy jako mapę. Grupy to ulice, a wartościowość to numer domu – pomaga znaleźć odpowiedni pierwiastek.
2. Analiza wzoru chemicznego.
Wzór chemiczny związku to kolejna wskazówka. Możemy wykorzystać znaną wartościowość jednego pierwiastka, aby obliczyć wartościowość drugiego.
Przykład: Weźmy wodę – H2O. Wiemy, że wodór (H) ma wartościowość I. Ile "rąk" ma tlen (O)?
We wzorze mamy dwa atomy wodoru, każdy z jednym "ręką" (2 x I = 2). Tlen musi mieć tyle "rąk", żeby zrównoważyć te dwa "ręce" wodoru. Zatem tlen ma wartościowość II.
Pomyśl o tym jak o wadze szalkowej. Po jednej stronie masz wodór z jego "rękami", a po drugiej tlen. Musi być równowaga!
3. Wartościowość pierwiastków o zmiennej wartościowości.
Niektóre pierwiastki są zmienne – mogą mieć różne wartościowości w różnych związkach. Najczęściej dotyczy to metali przejściowych (środek układu okresowego).
Przykład: Żelazo (Fe) może mieć wartościowość II (FeII) lub III (FeIII). Musimy to uwzględnić!
Jak to rozpoznać? Zazwyczaj podajemy wartościowość cyfrą rzymską w nazwie związku, np. tlenek żelaza(II) (FeO) i tlenek żelaza(III) (Fe2O3).
Pomyśl o tym jak o ubraniach. Żelazo może "ubrać się" w strój z dwoma "rękami" lub w strój z trzema "rękami" – w zależności od okazji (związku chemicznego).
Praktyczne przykłady.
Przykład 1: Chlorek sodu (NaCl). Sód (Na) należy do grupy 1, więc ma wartościowość I. Chlor (Cl) należy do grupy 17, więc ma wartościowość I. Wszystko się zgadza!
Przykład 2: Tlenek magnezu (MgO). Magnez (Mg) należy do grupy 2, więc ma wartościowość II. Tlen (O) należy do grupy 16, więc ma wartościowość II. Idealne połączenie!
Przykład 3: Tlenek węgla(IV) (CO2). Tlen (O) ma wartościowość II (i mamy dwa atomy tlenu, więc 2 x II = 4). Węgiel (C) musi mieć wartościowość IV, żeby zrównoważyć cztery "ręce" tlenu.
Podsumowanie.
Wartościowość to pojęcie kluczowe w chemii. Pamiętaj o "rękach" pierwiastków, układzie okresowym i analizie wzorów chemicznych. Ćwicz regularnie, a szybko staniesz się ekspertem od wartościowości!
Powodzenia w nauce!