Zrozumienie liczby elektronów walencyjnych pierwiastków jest kluczowe w chemii. Pozwala przewidywać ich właściwości chemiczne i sposób, w jaki tworzą wiązania z innymi atomami. Skupimy się na żelazie (Fe) i jego elektronach walencyjnych.
Czym są Elektrony Walencyjne?
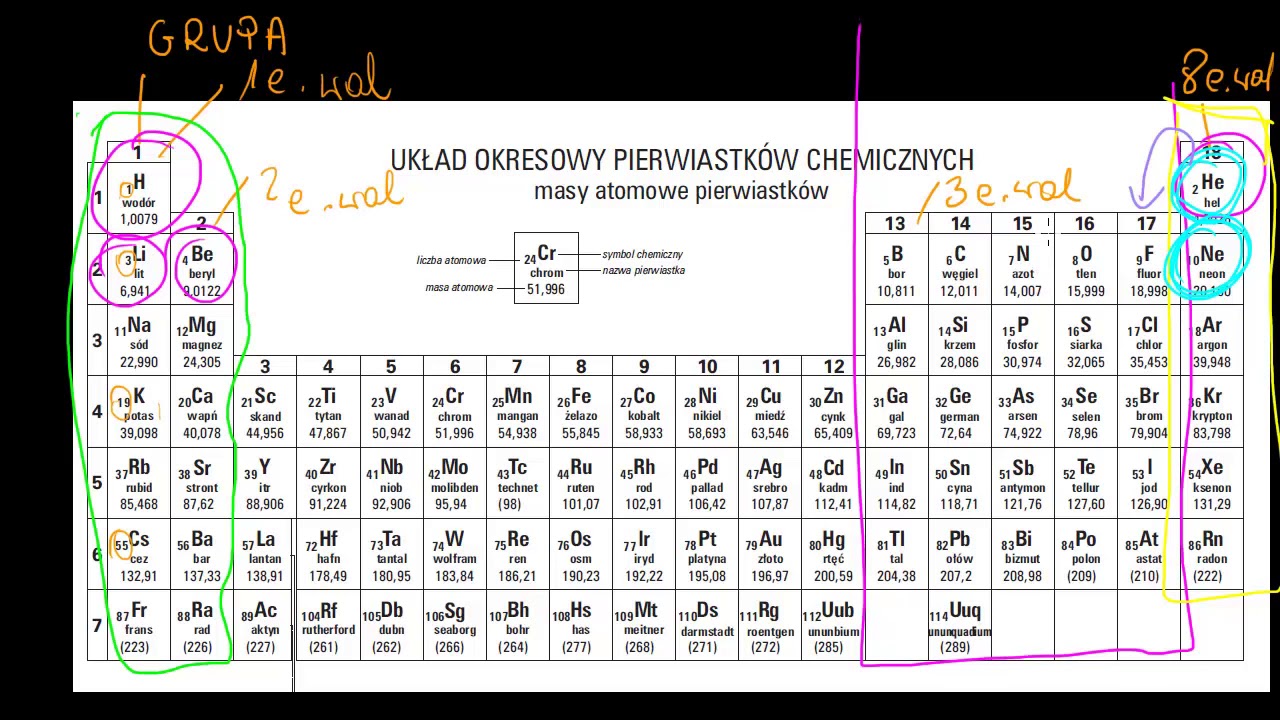
Elektrony walencyjne to elektrony znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu. To one biorą udział w tworzeniu wiązań chemicznych. Określają zdolność atomu do interakcji z innymi atomami.
Liczba elektronów walencyjnych wpływa na reaktywność pierwiastka. Atomy dążą do osiągnięcia stabilnej konfiguracji elektronowej, zwykle takiej, która ma 8 elektronów na powłoce walencyjnej (reguła oktetu) lub 2 elektrony (reguła dubletu, dla atomów takich jak wodór i hel).
Konfiguracja Elektronowa Żelaza
Żelazo (Fe) ma liczbę atomową 26. Oznacza to, że atom żelaza ma 26 protonów w jądrze i, w stanie neutralnym, 26 elektronów krążących wokół jądra. Konfiguracja elektronowa żelaza zapisywana jest następująco: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. To właśnie ta konfiguracja determinuje jego właściwości chemiczne.
Zwróć uwagę na podpowłoki 4s i 3d. Tradycyjnie, elektrony z podpowłoki 4s są rozważane jako elektrony walencyjne, ponieważ są najdalej od jądra. Jednakże, elektrony z podpowłoki 3d również mogą uczestniczyć w tworzeniu wiązań, szczególnie w związkach kompleksowych.
Ile Elektronów Walencyjnych Ma Żelazo?
Odpowiedź nie jest jednoznaczna. Zależy to od kontekstu i sposobu tworzenia wiązań. Najczęściej przyjmuje się, że żelazo ma 2 elektrony walencyjne. Są to elektrony z podpowłoki 4s2. Uczestniczą one w tworzeniu prostych związków jonowych i kowalencyjnych.
Jednak żelazo jest pierwiastkiem bloku d, co oznacza, że elektrony z podpowłoki 3d również mogą być zaangażowane w tworzenie wiązań. W niektórych przypadkach, żelazo może zachowywać się tak, jakby miało więcej niż 2 elektrony walencyjne, szczególnie w kompleksach koordynacyjnych. W takich kompleksach, elektrony z podpowłoki 3d stają się istotne, a liczba "elektronów walencyjnych" może być traktowana bardziej jako pojęcie formalne związane ze stopniem utlenienia.
Stopnie Utlenienia Żelaza
Żelazo występuje na różnych stopniach utlenienia, najczęściej +2 i +3. Stopień utlenienia to formalny ładunek, jaki atom miałby, gdyby wszystkie wiązania w związku były jonowe. Stopień utlenienia +2 (Fe2+) oznacza, że żelazo oddało (lub formalnie oddało) 2 elektrony. Stopień utlenienia +3 (Fe3+) oznacza, że żelazo oddało (lub formalnie oddało) 3 elektrony. Oznacza to, że zarówno elektrony z 4s jak i jeden z 3d mogą brać udział w tworzeniu wiązań.
Na przykład, w tlenku żelaza(II) (FeO), żelazo ma stopień utlenienia +2. W tlenku żelaza(III) (Fe2O3), żelazo ma stopień utlenienia +3. Te różne stopnie utlenienia wynikają z faktu, że elektrony z podpowłoki 3d mogą uczestniczyć w tworzeniu wiązań.
Żelazo w Związkach Kompleksowych
W związkach kompleksowych, żelazo często koordynuje się z wieloma ligandami (cząsteczkami lub jonami otaczającymi centralny atom żelaza). W takich przypadkach, elektrony d są kluczowe dla tworzenia wiązań koordynacyjnych. Liczba koordynacyjna żelaza (liczba ligandów bezpośrednio związanych z atomem żelaza) może być różna i wpływa na właściwości chemiczne kompleksu.
Przykładowo, hemoglobina, białko transportujące tlen we krwi, zawiera atom żelaza w kompleksie porfirynowym. Żelazo w hemoglobinie wiąże tlen, umożliwiając jego transport do tkanek. Elektrony d żelaza odgrywają kluczową rolę w tym procesie.
Podsumowanie
Chociaż często mówi się, że żelazo ma 2 elektrony walencyjne (4s2), to jego chemia jest bardziej złożona. Elektrony z podpowłoki 3d również mogą uczestniczyć w tworzeniu wiązań, szczególnie w związkach kompleksowych i związkach o różnych stopniach utlenienia. Zatem, określenie "liczby elektronów walencyjnych" dla żelaza zależy od kontekstu chemicznego i sposobu analizy wiązań. Najprościej jest powiedzieć, że żelazo *najczęściej* wykazuje 2 elektrony walencyjne (4s2), ale jego *rzeczywiste* zachowanie zależy od specyficznej sytuacji chemicznej.
Zrozumienie konfiguracji elektronowej żelaza i jego zdolności do występowania na różnych stopniach utlenienia jest niezbędne do zrozumienia jego roli w wielu procesach chemicznych i biologicznych.