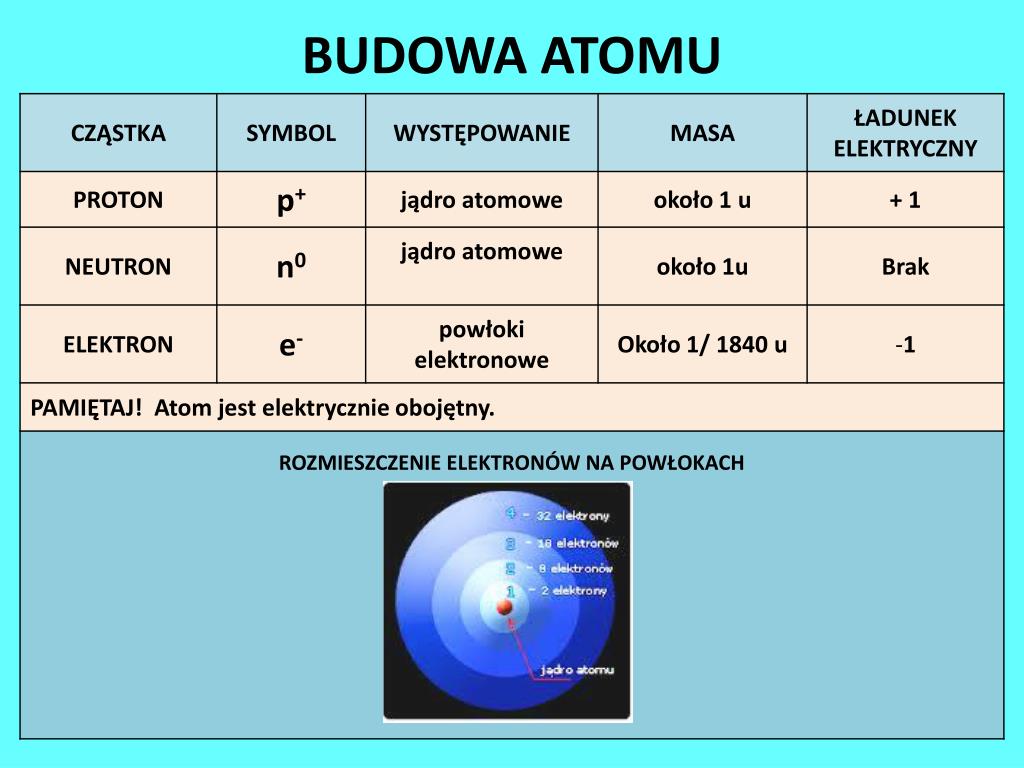
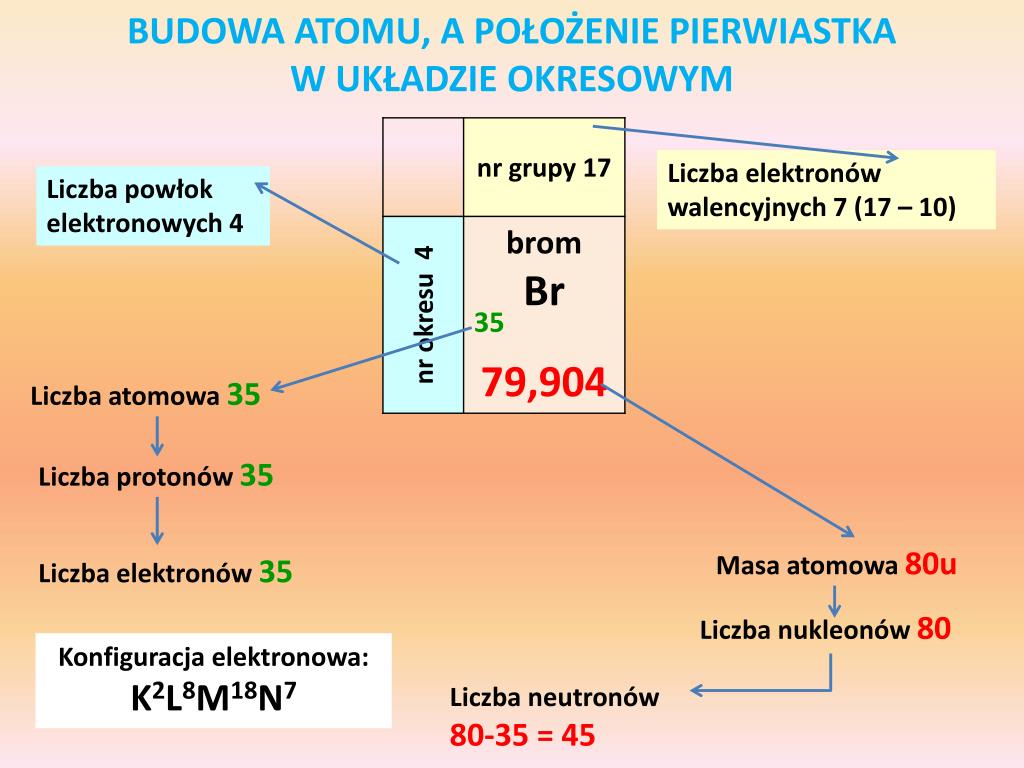
Fizyka atomowa w 1 Liceum zajmuje się badaniem budowy atomu i jego właściwości. Kluczowe wzory dotyczą przede wszystkim kwantyzacji energii, promieniowania, oraz zjawisk związanych z przejściami elektronowymi.
Kwantyzacja energii jest fundamentalną zasadą. Energia elektronu w atomie może przyjmować tylko określone, dyskretne wartości. Oznacza to, że elektron nie może mieć dowolnej energii, a jedynie te odpowiadające konkretnym poziomom energetycznym. Wzór na energię elektronu w atomie wodoru (model Bohra) to ważny przykład: En = -13.6 eV / n2, gdzie n jest liczbą kwantową.
Promieniowanie powstaje, gdy elektron przechodzi między poziomami energetycznymi. Jeśli elektron przeskakuje z wyższego poziomu na niższy, emitowany jest foton o energii równej różnicy energii tych poziomów: ΔE = hf, gdzie h to stała Plancka, a f to częstotliwość fotonu. Jeśli elektron absorbuje foton o odpowiedniej energii, może przeskoczyć na wyższy poziom energetyczny.
Długość fali de Broglie'a opisuje dualizm korpuskularno-falowy materii. Każda cząstka, w tym elektron, ma przypisaną falę o długości λ = h/p, gdzie p to pęd cząstki.
Przykład 1: Oblicz energię fotonu emitowanego, gdy elektron w atomie wodoru przeskakuje z n=3 na n=1. Należy obliczyć różnicę energii pomiędzy tymi poziomami i zastosować wzór ΔE = hf.
Przykład 2: Oblicz długość fali de Broglie'a dla elektronu o pędzie 1 x 10-24 kg m/s.
Zastosowania: Fizyka atomowa znajduje zastosowanie w wielu dziedzinach, od medycyny (diagnostyka obrazowa, radioterapia) po energetykę jądrową i produkcję laserów. Zrozumienie atomowej struktury materii jest kluczowe dla rozwoju nowoczesnych technologii.