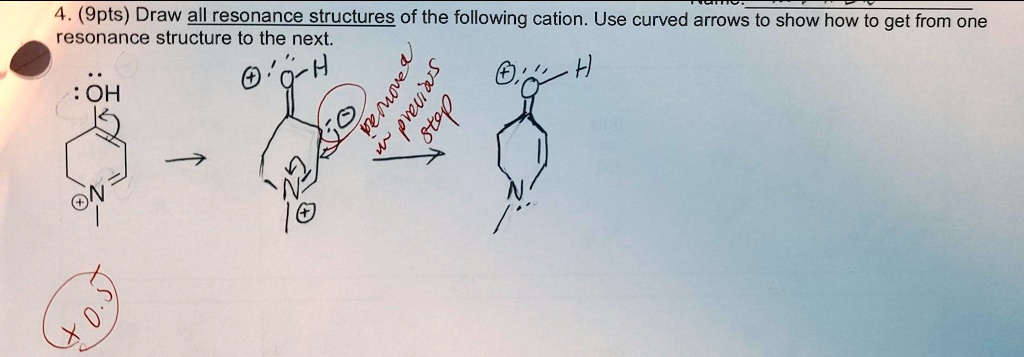
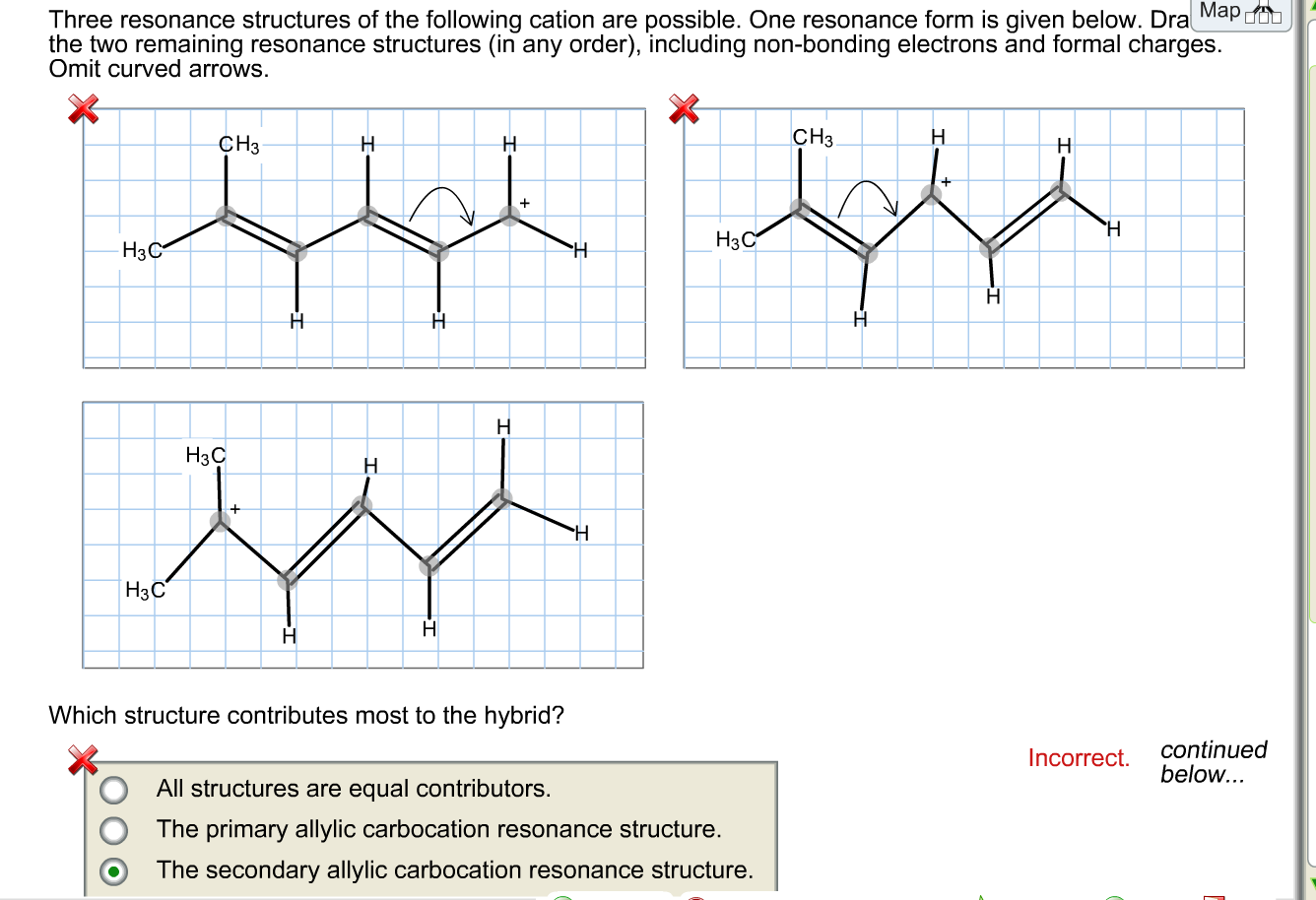
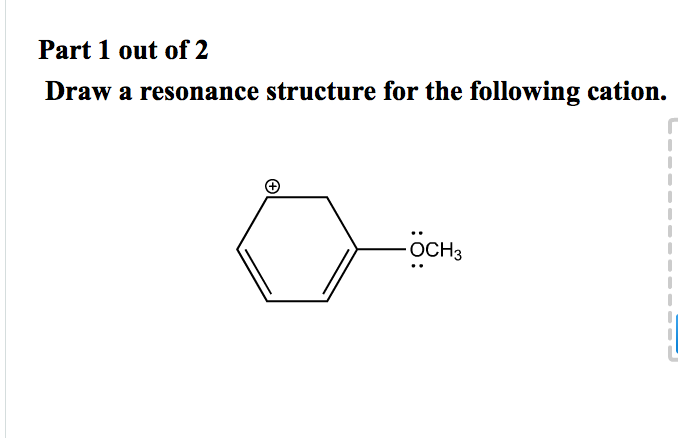
Cześć! Gotowi na przygodę ze strukturami rezonansowymi? Spróbujemy zrozumieć, jak je rysować. Szczególnie dla kationów. Bez obaw, brzmi skomplikowanie, ale to nic trudnego.
Co to jest rezonans?
Zacznijmy od podstaw. Wyobraź sobie, że masz przepis na ciasto. Możesz użyć różnych rodzajów mąki. Czasem pszennej, a czasem orkiszowej. Ciasto nadal będzie ciastem. Będzie podobne, ale trochę inne.
Rezonans w chemii jest podobny. To sposób przedstawienia jednej cząsteczki lub jonu za pomocą kilku struktur. Te struktury różnią się tylko rozmieszczeniem elektronów. Atomy zostają na swoich miejscach.
Struktury rezonansowe to takie "różne wersje" tej samej cząsteczki. Żadna z nich nie jest idealna. Prawdziwa struktura jest czymś pomiędzy. Jest hybrydą wszystkich struktur rezonansowych.
Pomyśl o nosorożcu. Wygląda trochę jak koń i trochę jak dinozaur. Ale nie jest ani koniem, ani dinozaurem. Jest nosorożcem. Hybrydą cech.
Kluczowe pojęcia
Zdefiniujmy kilka ważnych słów.
Struktura Lewisa: To rysunek, który pokazuje, jak atomy łączą się ze sobą. Pokazuje również, które elektrony są zaangażowane w wiązania. I które elektrony są wolne.
Elektrony walencyjne: To elektrony na zewnętrznej powłoce atomu. One uczestniczą w tworzeniu wiązań chemicznych.
Ładunek formalny: To sposób "podziału" elektronów między atomy w cząsteczce. Pomaga ocenić, która struktura Lewisa jest bardziej prawdopodobna.
Kation: Jon o ładunku dodatnim. Powstaje, gdy atom traci elektrony.
Jak rysować struktury rezonansowe kationów?
Teraz przejdźmy do rysowania. Skupimy się na kationach. To jony z ładunkiem dodatnim.
Krok 1: Narysuj strukturę Lewisa
Najpierw musisz narysować poprawną strukturę Lewisa. Upewnij się, że policzyłeś wszystkie elektrony walencyjne. Upewnij się, że wszystkie atomy mają oktet (8 elektronów) lub dublet (2 elektrony dla wodoru), jeśli to możliwe. Pamiętaj o ładunku dodatnim.
Krok 2: Znajdź miejsca, gdzie rezonans jest możliwy
Rezonans jest możliwy, gdy masz:
- Wiązania podwójne lub potrójne obok wiązania pojedynczego.
- Wolne pary elektronowe obok wiązania podwójnego lub potrójnego.
- Ładunek dodatni obok wiązania podwójnego lub wolnej pary elektronowej.
Szukaj tych sytuacji w swojej cząsteczce.
Krok 3: Przesuń elektrony
Użyj zakrzywionych strzałek. Pokaż, jak elektrony się przemieszczają. Strzałka zawsze zaczyna się od elektronów. I kończy się tam, gdzie elektrony idą.
Przesuwaj tylko elektrony. Nie przesuwaj atomów!
Pamiętaj, że ładunek formalny może się zmienić na atomach, na które wpływa przesunięcie elektronów.
Krok 4: Narysuj nowe struktury
Narysuj wszystkie możliwe struktury rezonansowe. Zwróć uwagę na ładunki formalne.
Krok 5: Oceń struktury
Niektóre struktury są bardziej stabilne niż inne. Stabilność zależy od:
- Minimalizacji ładunków formalnych.
- Umieszczenia ładunku ujemnego na bardziej elektroujemnym atomie.
- Spełnienia reguły oktetu przez wszystkie atomy.
Bardziej stabilne struktury mają większy wkład w hybrydę rezonansową.
Przykład
Rozważmy kation allilowy: CH2=CH-CH2+
Krok 1: Struktura Lewisa
Mamy trzy atomy węgla. Pierwszy atom węgla ma wiązanie podwójne z drugim. Drugi atom węgla ma wiązanie pojedyncze z trzecim. Trzeci atom węgla ma ładunek dodatni.
Krok 2: Rezonans
Wiązanie podwójne znajduje się obok kationu. Rezonans jest możliwy!
Krok 3: Przesunięcie elektronów
Elektrony z wiązania podwójnego przesuwają się w stronę atomu węgla z ładunkiem dodatnim. Użyjemy zakrzywionej strzałki, aby to pokazać.
Krok 4: Nowe struktury
Powstaje nowa struktura. Teraz wiązanie podwójne jest między drugim i trzecim atomem węgla. Pierwszy atom węgla ma teraz ładunek dodatni. Czyli mamy CH2+-CH=CH2
Krok 5: Ocena
Obie struktury są równoważne. Mają taki sam wkład w hybrydę rezonansową.
Wskazówki
Oto kilka wskazówek, które pomogą Ci rysować struktury rezonansowe.
- Zawsze rysuj strzałki zakrzywione, pokazujące ruch elektronów.
- Przesuwaj tylko elektrony, nie atomy.
- Sprawdź ładunki formalne w każdej strukturze.
- Zastanów się, które struktury są bardziej stabilne.
Dlaczego to jest ważne?
Zrozumienie rezonansu jest ważne. Pomaga przewidywać właściwości cząsteczek. Takich jak stabilność i reaktywność.
Wiele leków i materiałów ma struktury rezonansowe. Rezonans wpływa na ich działanie.
Podsumowanie
Rezonans to sposób przedstawienia cząsteczki lub jonu za pomocą kilku struktur Lewisa. Te struktury różnią się tylko rozmieszczeniem elektronów.
Rysowanie struktur rezonansowych kationów wymaga kilku kroków. Narysuj strukturę Lewisa. Znajdź miejsca, gdzie rezonans jest możliwy. Przesuń elektrony za pomocą zakrzywionych strzałek. Narysuj nowe struktury. Oceń ich stabilność.
Pamiętaj, że prawdziwa struktura jest hybrydą wszystkich struktur rezonansowych. To zrozumienie pomoże Ci lepiej poznać chemię organiczną. Powodzenia!