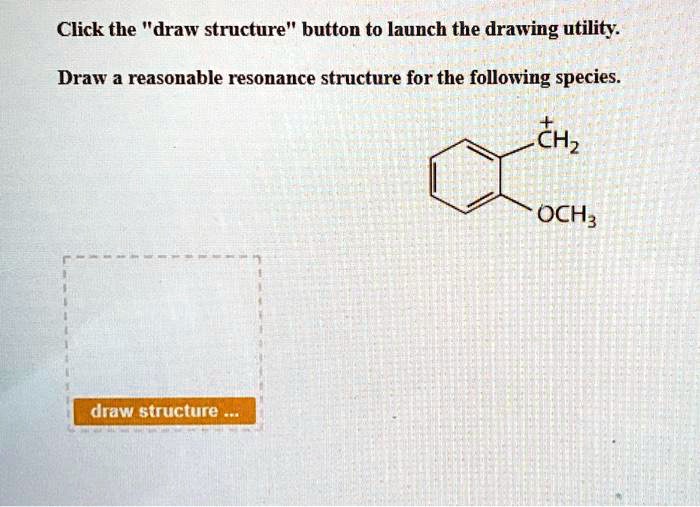
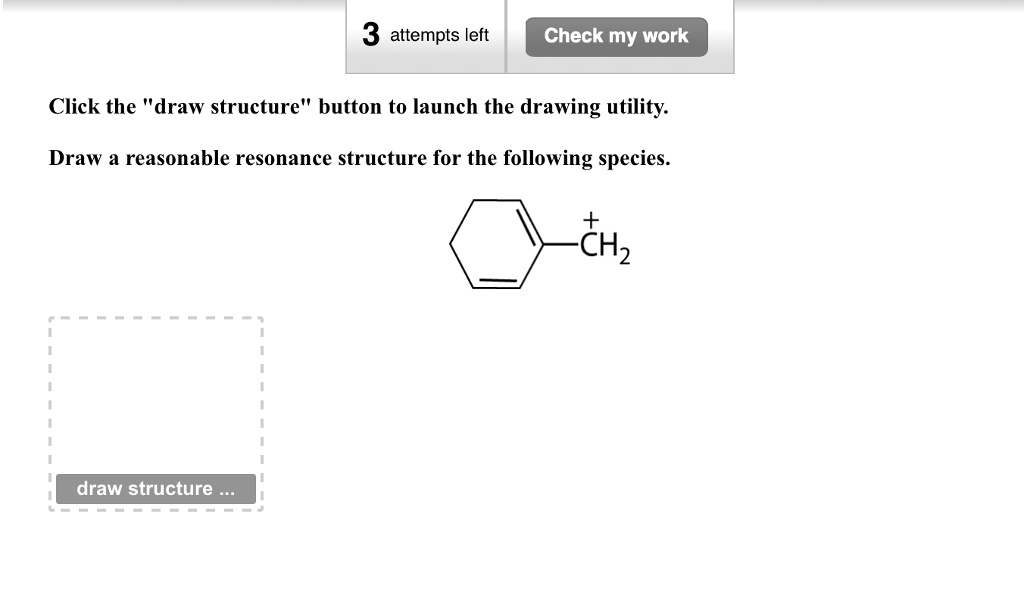
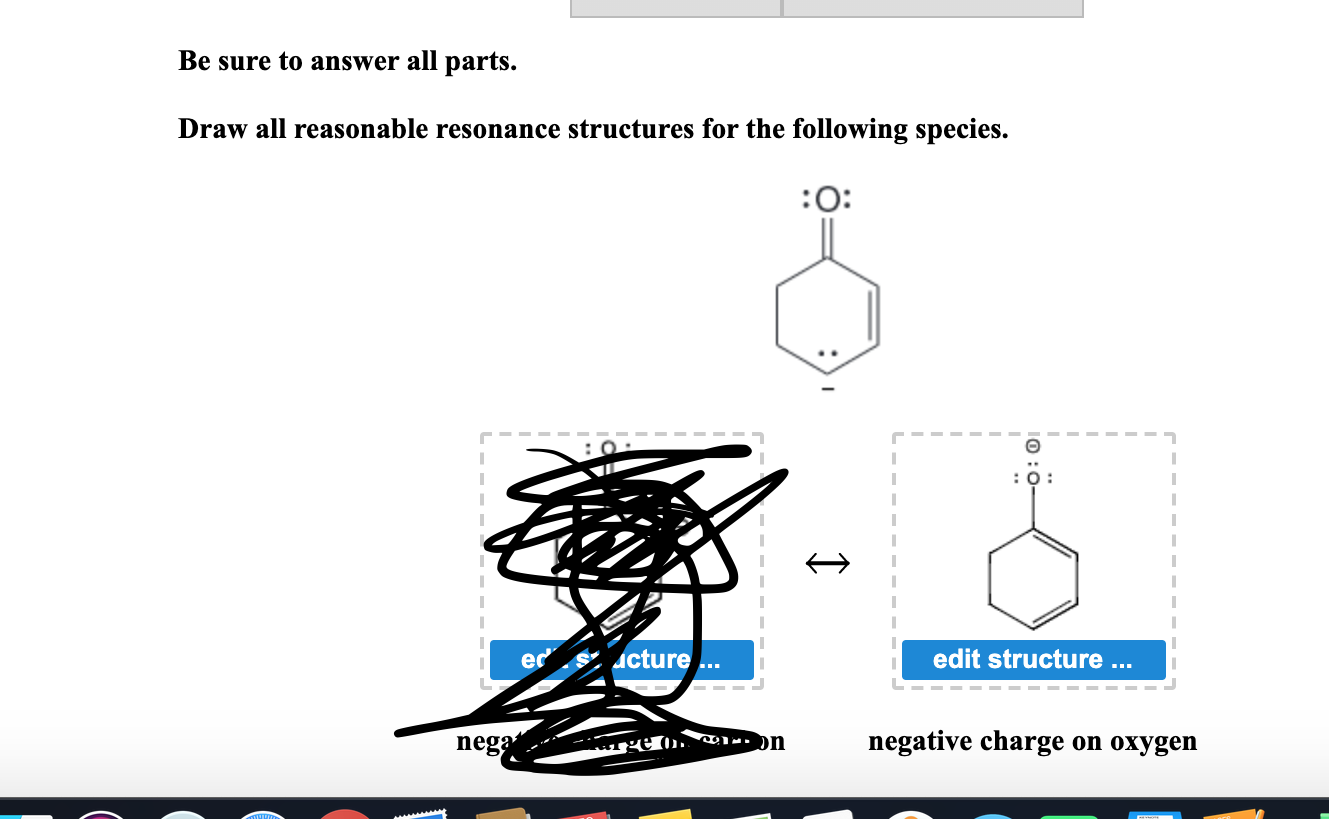
Hej! Zaraz przejdziemy przez rezonans. Pokażę Ci, jak rysować sensowne struktury rezonansowe. Dasz radę!
Czym jest Rezonans?
Rezonans to po prostu sposób przedstawienia, jak elektrony są rozproszone w cząsteczce. Nie jest to oscylacja. To różne, ale poprawne struktury Lewisa tej samej cząsteczki.
Żadna pojedyncza struktura Lewisa nie oddaje w pełni wiązań. Dlatego rysujemy kilka struktur rezonansowych.
Rzeczywista struktura jest hybrydą tych form.
Kiedy Rysować Struktury Rezonansowe?
Rysujemy struktury rezonansowe, gdy:
- Mamy wiązania podwójne lub potrójne.
- Mamy wolne pary elektronowe przy atomie sąsiadującym z wiązaniem wielokrotnym.
- Mamy ładunek formalny.
Jak Rysować Struktury Rezonansowe?
Krok po kroku:
Krok 1: Znajdź Potencjalne Miejsca Rezonansu
Szukaj wiązań π (podwójnych, potrójnych) oraz wolnych par elektronowych.
Krok 2: Użyj Strzałek
Strzałki pokazują ruch elektronów. Zawsze od elektronów do wiązania. Nigdy odwrotnie!
Strzałka z wolnej pary tworzy wiązanie.
Strzałka z wiązania π tworzy wolną parę.
Krok 3: Rysuj Nową Strukturę
Narysuj nową strukturę Lewisa z uwzględnieniem przesuniętych elektronów.
Pamiętaj o zachowaniu liczby elektronów walencyjnych.
Oblicz ładunki formalne dla każdego atomu.
Krok 4: Oceń Struktury
Oceń, czy struktura jest rozsądna. Patrz na:
- Minimalizacja ładunków formalnych.
- Ujemny ładunek na bardziej elektroujemnym atomie.
- Unikanie oddzielania ładunków (dużego ładunku dodatniego i ujemnego w strukturze).
- Sprawdź, czy atom nie przekracza oktetu (szczególnie dla pierwiastków 2 okresu).
Przykłady
Przykład 1: Ozon (O3)
Mamy trzy atomy tlenu połączone w linię. Jeden z tlenów tworzy wiązanie podwójne, a drugi pojedyncze.
Możemy przenieść elektrony z wiązania π na atom tlenu z wiązaniem pojedynczym. Powstaje nowa struktura z wiązaniem pojedynczym po lewej i podwójnym po prawej.
Przykład 2: Jon Azotanowy (NO3-)
Atom azotu połączony z trzema atomami tlenu. Jeden z tlenów łączy się wiązaniem podwójnym, a pozostałe pojedynczymi i posiadają ładunek formalny -1.
Możemy "obracać" wiązanie podwójne między trzema atomami tlenu. Otrzymujemy trzy struktury rezonansowe.
Przykład 3: Benzen (C6H6)
Sześć atomów węgla tworzy pierścień. Wiązania podwójne i pojedyncze na przemian.
Możemy "przesunąć" wszystkie wiązania π o jedno miejsce. Otrzymujemy drugą strukturę rezonansową.
Czego Unikać?
- Przesuwania atomów. Tylko elektrony się poruszają.
- Łamania zasady oktetu (dla atomów 2 okresu).
- Tworzenia struktur z dużymi i oddzielonymi ładunkami.
- Ignorowania ładunków formalnych.
Wskazówki
Ćwicz! Im więcej ćwiczysz, tym lepiej będziesz rysować struktury rezonansowe.
Zacznij od prostych cząsteczek. Potem przejdź do bardziej skomplikowanych.
Sprawdzaj swoje odpowiedzi. Upewnij się, że struktura jest rozsądna.
Podsumowanie
Rezonans to rozproszenie elektronów. Rysujemy struktury rezonansowe, aby lepiej opisać wiązania.
Strzałki pokazują ruch elektronów. Zawsze od elektronów do wiązania.
Oceń strukturę pod kątem ładunków formalnych i stabilności.
Pamiętaj, tylko elektrony się poruszają. Atomy zostają na swoim miejscu.
Powodzenia na egzaminie! Wiem, że dasz radę!