Hej Studencie! Przygotuj się na fascynującą podróż po świecie chemii organicznej. Dziś odpowiemy na pytanie: dlaczego benzen nie odbarwia wody bromowej? Brzmi skomplikowanie? Bez obaw, wszystko stanie się jasne!
Wprowadzenie: Reakcje Addycji i Benzen
Zacznijmy od podstaw. Pamiętasz, czym są reakcje addycji? To reakcje, w których do związku nienasyconego (zawierającego wiązania podwójne lub potrójne) przyłączają się atomy lub grupy atomów. Przykładem jest odbarwianie wody bromowej przez alkeny i alkiny.
Woda bromowa ma charakterystyczny, brązowy kolor. Gdy alken lub alkin wejdzie z nią w reakcję, brom przyłącza się do wiązania wielokrotnego. W efekcie, woda bromowa traci kolor – odbarwia się. Świadczy to o zajściu reakcji addycji.
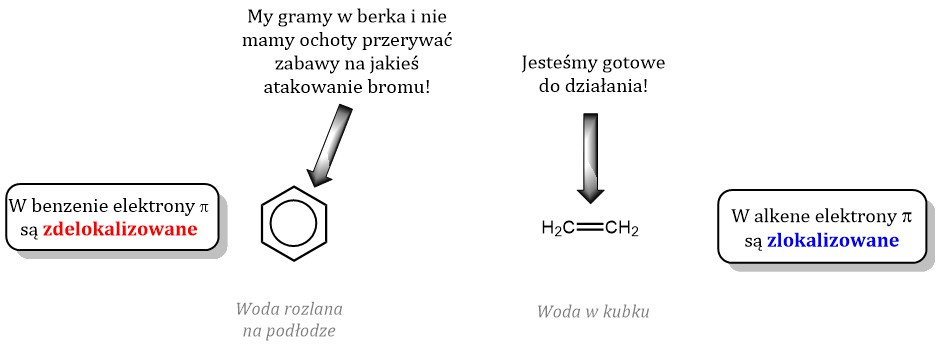
No dobrze, a co z benzenem? Na pierwszy rzut oka, wygląda podobnie do alkenów. Ma przecież wiązania podwójne! Dlaczego więc nie odbarwia wody bromowej? To właśnie sedno naszego dzisiejszego tematu.
Struktura Benzenu: Klucz do Tajemnicy
Struktura benzenu jest wyjątkowa. To sześciowęglowy pierścień, w którym formalnie występują naprzemiennie wiązania pojedyncze i podwójne. Jednak to tylko uproszczony model.
W rzeczywistości, elektrony pi (czyli te z wiązań podwójnych) są zdelokalizowane. Oznacza to, że nie należą do konkretnej pary atomów węgla, ale rozciągają się na cały pierścień.
Wyobraź sobie, że to taki chmura elektronowa nad i pod pierścieniem. Ta delokalizacja elektronów prowadzi do powstania bardzo stabilnej struktury. Mówimy o rezonansie.
Ta stabilność jest kluczowa! Benzen "niechętnie" reaguje w reakcjach addycji, ponieważ naruszyłyby one jego stabilny system elektronowy. Addycja zniszczyłaby pierścień i jego charakterystyczny rozkład elektronów.
Reakcja Substytucji Elektrofilowej
Zamiast reakcji addycji, benzen preferuje reakcje substytucji elektrofilowej. W reakcji tej, atom wodoru w pierścieniu benzenowym zostaje zastąpiony przez inny atom lub grupę atomów (elektrofil).
Reakcje substytucji zachowują nienaruszony pierścień benzenowy i jego stabilną strukturę. Wymagają jednak zwykle obecności katalizatora.
Aby benzen zareagował z wodą bromową i odbarwił ją (czyli przeszedł reakcję addycji), potrzebne są ekstremalne warunki i silne katalizatory. W normalnych warunkach, reakcja nie zachodzi.
Woda Bromowa a Benzen: Podsumowanie Dlaczego Nie Zachodzi Reakcja
Podsumujmy, dlaczego benzen nie odbarwia wody bromowej w normalnych warunkach:
- Stabilność struktury: Delokalizacja elektronów pi w pierścieniu benzenowym sprawia, że jest on bardzo stabilny.
- Rezonans: Energia rezonansu (energia stabilizacji) jest duża, co utrudnia rozerwanie pierścienia.
- Preferencja reakcji substytucji: Benzen preferuje reakcje substytucji elektrofilowej, które zachowują nienaruszony pierścień.
- Brak reakcji addycji w normalnych warunkach: Aby doszło do addycji, potrzebne są ekstremalne warunki i silne katalizatory.
Przykłady Reakcji Benzenu
Chcesz zobaczyć, jak reaguje benzen w reakcji substytucji elektrofilowej? Oto kilka przykładów:
- Nitrowanie: Wprowadzenie grupy nitrowej (-NO2) do pierścienia benzenowego.
- Sulfonowanie: Wprowadzenie grupy sulfonowej (-SO3H) do pierścienia benzenowego.
- Halogenowanie: Wprowadzenie atomu halogenu (np. chloru, bromu) do pierścienia benzenowego. W tym przypadku z bromem (Br2) reakcja przebiega w obecności katalizatora, np. FeBr3.
- Alkilowanie Friedela-Craftsa: Wprowadzenie grupy alkilowej do pierścienia benzenowego.
- Acylowanie Friedela-Craftsa: Wprowadzenie grupy acylowej do pierścienia benzenowego.
Zauważ, że w każdej z tych reakcji, pierścień benzenowy pozostaje nienaruszony. To właśnie esencja substytucji elektrofilowej!
Porady Egzaminacyjne
Pamiętaj na egzaminie o kilku kluczowych sprawach:
- Zdefiniuj reakcję addycji i podaj przykłady (np. odbarwianie wody bromowej przez alkeny).
- Wyjaśnij strukturę benzenu i koncepcję delokalizacji elektronów pi.
- Opisz stabilność benzenu wynikającą z rezonansu.
- Wyjaśnij, dlaczego benzen preferuje reakcje substytucji elektrofilowej.
- Podaj przykłady reakcji substytucji elektrofilowej benzenu.
Podsumowanie
Gratulacje! Przeszliśmy przez najważniejsze aspekty związane z brakiem reakcji benzenu z wodą bromową w normalnych warunkach. Pamiętaj, kluczem jest zrozumienie struktury i stabilności benzenu. Powodzenia na egzaminie!