Cześć! Dzisiaj nauczymy się rysować struktury Lewisa dla związku NO2, czyli dwutlenku azotu. To trochę jak rysowanie mapy, która pokazuje, jak atomy łączą się ze sobą.
Czym jest Struktura Lewisa?
Struktura Lewisa to diagram, który pokazuje, jak elektrony walencyjne (czyli te na zewnętrznej powłoce atomu) są rozmieszczone w cząsteczce. Wyobraź sobie, że atomy to klocki, a elektrony to spoiwo, które je łączy. Struktura Lewisa pokazuje, gdzie jest spoiwo i jak mocno trzyma klocki razem.
Elektrony walencyjne są bardzo ważne, ponieważ decydują o tym, jak atom będzie się łączył z innymi atomami. Pomyśl o nich jak o rzepach, które przyczepiają się do innych rzepów.
Atomy dążą do osiągnięcia oktetu, czyli posiadania 8 elektronów na swojej zewnętrznej powłoce (z wyjątkiem wodoru, który dąży do 2). Osiągają to poprzez łączenie się z innymi atomami i dzielenie się z nimi elektronami. To jak dzielenie się pizzą, żeby każdy miał po równo.
Krok 1: Zliczanie Elektronów Walencyjnych
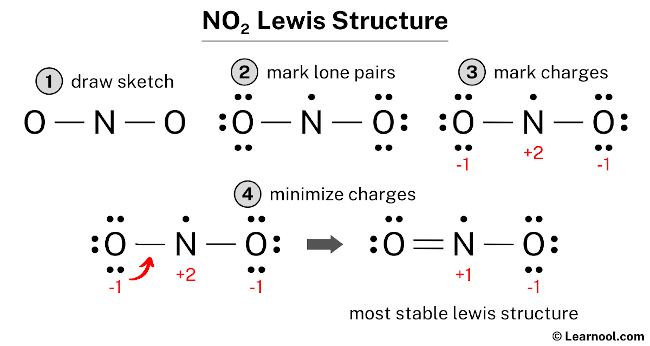
Pierwszy krok to policzenie, ile elektronów walencyjnych mają wszystkie atomy w NO2. Azot (N) znajduje się w 15 grupie układu okresowego, więc ma 5 elektronów walencyjnych. Tlen (O) znajduje się w 16 grupie, więc ma 6 elektronów walencyjnych.
Mamy jeden atom azotu i dwa atomy tlenu. Więc liczymy: (1 atom N * 5 elektronów/atom) + (2 atomy O * 6 elektronów/atom) = 5 + 12 = 17 elektronów walencyjnych. Zapamiętaj tę liczbę – 17.
Wyobraź sobie, że masz 17 cukierków, które musisz sprawiedliwie rozdzielić między atomy azotu i tlenu tak, żeby każdy był zadowolony.
Krok 2: Umieszczanie Atomów
Teraz musimy zdecydować, który atom będzie w centrum struktury. Zazwyczaj atom o mniejszej elektroujemności umieszcza się w centrum. W przypadku NO2, azot jest mniej elektroujemny niż tlen, więc umieszczamy go w centrum, a tleny po bokach: O-N-O.
To trochę jak budowanie piramidy. Azot jest podstawą, a tleny to ściany boczne.
Krok 3: Tworzenie Wiązań Pojedynczych
Następnie tworzymy wiązania pojedyncze między atomem centralnym (azotem) a atomami zewnętrznymi (tlenami). Każde wiązanie pojedyncze reprezentuje parę elektronów, czyli 2 elektrony.
Rysujemy kreskę między N i każdym O: O-N-O. Użyliśmy dwóch wiązań pojedynczych, czyli 2 * 2 = 4 elektrony. Z naszych 17 elektronów walencyjnych zostaje nam 17 - 4 = 13 elektronów do rozdysponowania.
Pomyśl o tym jak o budowaniu mostów między atomami. Każdy most potrzebuje dwóch "desek", czyli dwóch elektronów.
Krok 4: Uzupełnianie Oktetu Atomów Zewnętrznych
Teraz uzupełniamy oktet dla atomów zewnętrznych, czyli dla tlenów. Każdy atom tlenu ma już jedno wiązanie, czyli 2 elektrony. Potrzebuje jeszcze 6 elektronów, aby mieć 8.
Dodajemy 6 elektronów (3 pary elektronów) do każdego atomu tlenu: O=6 elektronów - N - O=6 elektronów. Zużyliśmy 2 * 6 = 12 elektronów. Został nam 1 elektron: 13 - 12 = 1 elektron.
To jak dawanie każdemu atomowi tlenu "czapeczki" z sześcioma "pomponami" (elektronami), żeby było im ciepło.
Krok 5: Umieszczanie Pozostałych Elektronów na Atomie Centralnym
Został nam 1 elektron. Umieszczamy go na atomie centralnym, czyli na azocie. To dlatego NO2 jest przykładem cząsteczki z nieparzystą liczbą elektronów.
Azot ma teraz 2 wiązania pojedyncze (4 elektrony) + 1 elektron = 5 elektronów. Nadal brakuje mu 3 elektronów do oktetu.
Krok 6: Tworzenie Wiązania Podwójnego
Aby azot zbliżył się do oktetu, tworzymy wiązanie podwójne z jednym z atomów tlenu. Zamiast jednego wiązania pojedynczego (2 elektrony), rysujemy dwa wiązania (4 elektrony) z jednym z tlenów.
O=4 elektrony=N - O=6 elektronów + 1 elektron na azocie. Teraz jeden tlen ma 8 elektronów (4 z wiązania podwójnego i 4 z par elektronowych), azot ma 6 elektronów (4 z wiązania podwójnego, 1 z wiązania pojedynczego i 1 wolny elektron), a drugi tlen ma 7 elektronów (2 z wiązania pojedynczego i 6 z par elektronowych).
Krok 7: Ładunki Formalne (Opcjonalne, ale przydatne)
Możemy obliczyć ładunki formalne dla każdego atomu, aby ocenić, czy struktura Lewisa jest "najlepsza". Ładunek formalny obliczamy odejmując od liczby elektronów walencyjnych atomu liczbę elektronów niewiążących (czyli tych w parach elektronowych) oraz połowę liczby elektronów wiążących (czyli tych w wiązaniach).
Dla tlenu z wiązaniem podwójnym: 6 (elektrony walencyjne) - 4 (elektrony niewiążące) - 4/2 (połowa elektronów wiążących) = 6 - 4 - 2 = 0.
Dla azotu: 5 (elektrony walencyjne) - 1 (elektron niewiążący) - 6/2 (połowa elektronów wiążących) = 5 - 1 - 3 = +1.
Dla tlenu z wiązaniem pojedynczym: 6 (elektrony walencyjne) - 6 (elektrony niewiążące) - 2/2 (połowa elektronów wiążących) = 6 - 6 - 1 = -1.
W idealnej strukturze Lewisa ładunki formalne powinny być jak najbliższe zeru. Nasza struktura ma ładunki formalne 0, +1 i -1, co nie jest idealne, ale akceptowalne. Pamiętaj, że NO2 jest cząsteczką, która nie spełnia reguły oktetu.
Podsumowanie
Gratulacje! Narysowaliśmy strukturę Lewisa dla NO2. To nie jest idealna struktura pod względem oktetu, ale pokazuje, jak atomy są połączone i jak rozmieszczone są elektrony. Pamiętaj, że chemia to nie tylko sztywne reguły, ale także wyjątki i niuanse.
Ćwicz rysowanie struktur Lewisa dla innych związków, a z czasem staniesz się w tym ekspertem!