Dzisiaj zajmiemy się solami. Sole to bardzo ważna grupa związków chemicznych. Spotykamy je na co dzień. Na przykład, sól kuchenna.
Co to są sole?
Sole to związki chemiczne. Powstają w wyniku reakcji kwasu z zasadą. Nazywamy to reakcją zobojętniania. Możemy też otrzymać sole w inny sposób, np. reakcja metalu z kwasem lub tlenku metalu z kwasem.
Sole składają się z kationu metalu (lub kationu amonu NH4+) oraz anionu reszty kwasowej. To połączenie jonowe. Dzięki temu sole często tworzą kryształy.
Wzór ogólny soli
Wzór ogólny soli to MxRy. M oznacza metal. R oznacza resztę kwasową. x i y to wartościowości. Trzeba je odpowiednio dobrać. Suma ładunków musi być równa zero.
Nazewnictwo soli
Nazwa soli składa się z dwóch członów. Najpierw nazwa reszty kwasowej. Potem nazwa metalu. Na przykład, chlorek sodu (NaCl). Chlorek (resztka kwasowa) i sód (metal).
Jeśli metal ma więcej niż jedną wartościowość, trzeba ją podać w nazwie. Robimy to za pomocą cyfry rzymskiej w nawiasie. Na przykład, chlorek żelaza(II) (FeCl2). Żelazo występuje na wartościowości II.
Dla soli kwasów beztlenowych stosujemy końcówkę "-ek". Na przykład, siarczek, chlorek, fluorek. Dla soli kwasów tlenowych stosujemy końcówkę "-an". Na przykład, siarczan, azotan, fosforan.
Przykłady soli
Chlorek sodu (NaCl). To sól kuchenna. Używamy jej do przyprawiania potraw. Jest też ważna w przemyśle chemicznym.
Węglan wapnia (CaCO3). To składnik wapienia, marmuru i kredy. Używany w budownictwie i przemyśle wapienniczym.
Siarczan miedzi(II) (CuSO4). Ma niebieski kolor. Stosowany jako środek grzybobójczy w rolnictwie.
Azotan potasu (KNO3). To saletra potasowa. Używany jako nawóz sztuczny i w produkcji prochu.
Właściwości soli
Sole zazwyczaj są ciałami stałymi. Mają postać kryształów. Mają wysokie temperatury topnienia i wrzenia. Często dobrze rozpuszczają się w wodzie. Roztwory soli przewodzą prąd elektryczny. Dzieje się tak, ponieważ zawierają jony.
Rozpuszczalność soli zależy od rodzaju soli i temperatury. Niektóre sole są bardzo dobrze rozpuszczalne. Inne słabo rozpuszczalne. Rozpuszczalność rośnie wraz z temperaturą. Zazwyczaj. Ale są wyjątki.
Dysocjacja jonowa
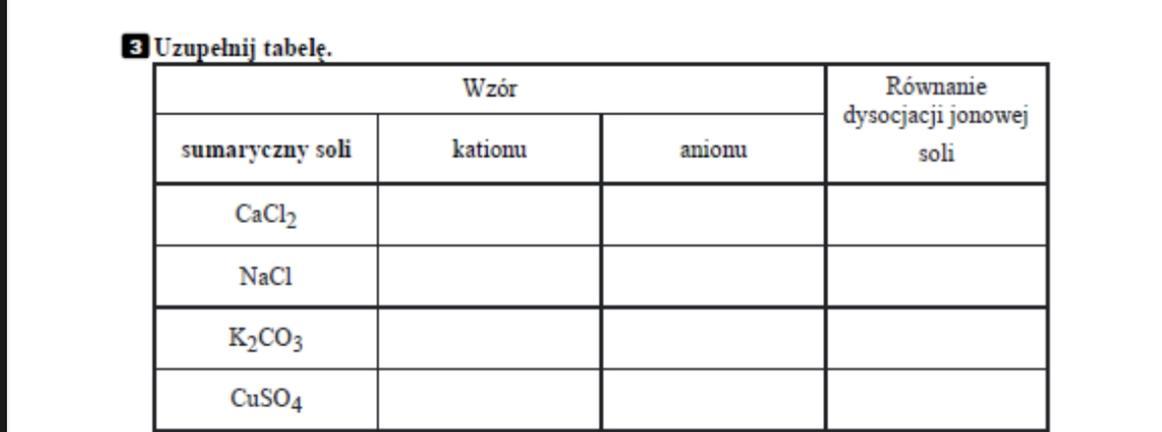
Sole rozpuszczone w wodzie ulegają dysocjacji jonowej. Oznacza to, że rozpadają się na jony. Kationy metalu i aniony reszty kwasowej. Na przykład: NaCl → Na+ + Cl-.
Otrzymywanie soli
Reakcja kwasu z zasadą (zobojętnianie). To najpopularniejszy sposób. Na przykład: HCl + NaOH → NaCl + H2O.
Reakcja metalu z kwasem. Na przykład: Zn + H2SO4 → ZnSO4 + H2.
Reakcja tlenku metalu z kwasem. Na przykład: CuO + 2HCl → CuCl2 + H2O.
Reakcja metalu z niemetalem. Na przykład: 2Na + Cl2 → 2NaCl.
Reakcja tlenku kwasowego z tlenkiem zasadowym. Na przykład: CaO + SO2 → CaSO3.
Zastosowanie soli
Sole mają szerokie zastosowanie. W przemyśle, rolnictwie, medycynie i w życiu codziennym.
Sól kuchenna (NaCl). Jako przyprawa. Do konserwowania żywności. W przemyśle chemicznym.
Nawozy sztuczne. Zawierają sole, np. azotany, fosforany. Dostarczają roślinom składników odżywczych.
Leki. Wiele leków to sole. Na przykład, tabletki musujące zawierają węglan sodu.
Przemysł budowlany. Wapień (CaCO3) do produkcji cementu i wapna.
Przemysł szklarski. Dodatek soli do masy szklanej.
Reakcje charakterystyczne
Sole można identyfikować za pomocą reakcji charakterystycznych. To reakcje, które dają specyficzny efekt. Na przykład, zmiana koloru lub powstanie osadu.
Wykrywanie jonów chlorkowych (Cl-). Dodajemy azotan srebra(I) (AgNO3). Powstaje biały osad chlorku srebra (AgCl).
Wykrywanie jonów siarczanowych (SO42-). Dodajemy chlorek baru (BaCl2). Powstaje biały osad siarczanu baru (BaSO4).
Znajomość soli i ich właściwości jest ważna. Pomaga zrozumieć wiele procesów chemicznych. I ich zastosowanie w życiu codziennym.