Hej! Czujesz zbliżający się sprawdzian z chemii w klasie 8? Spokojnie, wspólnie przejdziemy przez temat kwasów i przygotujemy Cię do niego!
Czym są kwasy? Definicja i podstawy
Zacznijmy od podstaw. Kwasy to związki chemiczne, które w roztworze wodnym oddają jony wodorowe (H+). To właśnie obecność tych jonów nadaje im charakterystyczne właściwości. Pomyśl o cytrynie – jej kwaśny smak bierze się właśnie z obecności kwasu cytrynowego!
W chemii używamy różnych definicji kwasów. Najpopularniejsza to definicja Arrheniusa, która mówi, że kwasy to substancje, które zwiększają stężenie jonów wodorowych w wodzie. Istnieją też bardziej zaawansowane definicje, jak teoria Brønsteda-Lowry'ego, ale na potrzeby sprawdzianu w 8 klasie skupmy się na definicji Arrheniusa.
Jak rozpoznać kwas?
Kwasy mają kilka cech charakterystycznych. Najbardziej oczywista to kwaśny smak. Pamiętaj jednak, że nigdy nie próbuj kwasów w laboratorium! Robienie tego jest bardzo niebezpieczne. Innym sposobem na rozpoznanie kwasu jest użycie wskaźników.
Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Najpopularniejszy wskaźnik to lakmus – w roztworze kwasowym staje się czerwony. Podobnie zachowuje się oranż metylowy, który również barwi się na czerwono. Inny wskaźnik, fenoloftaleina, pozostaje bezbarwna w roztworach kwasowych.
Podział kwasów
Kwasy można podzielić na różne sposoby. Najprostszy podział to podział ze względu na pochodzenie: na kwasy beztlenowe i kwasy tlenowe.
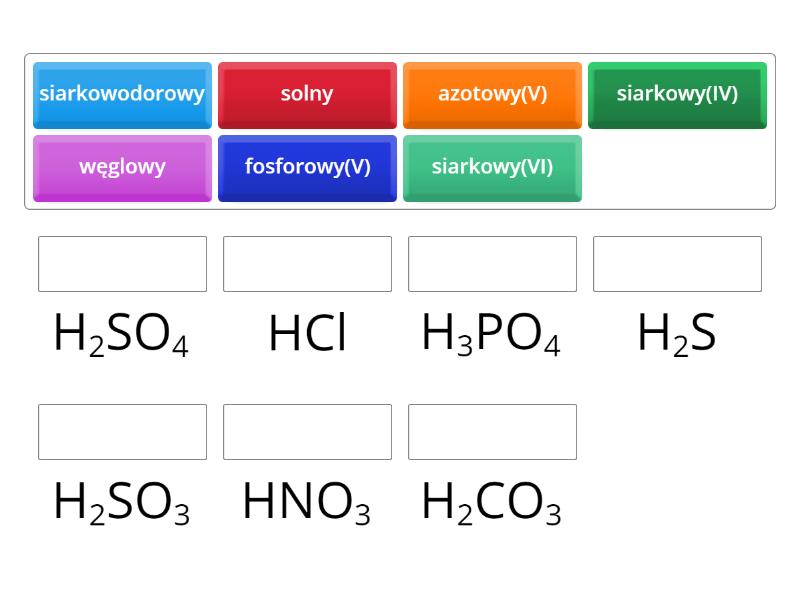
Kwasy beztlenowe zbudowane są z wodoru i niemetalu. Najważniejszym przykładem jest kwas chlorowodorowy (HCl), zwany również kwasem solnym. Używa się go w przemyśle i w żołądku do trawienia pokarmów. Inne przykłady to kwas fluorowodorowy (HF) i kwas siarkowodorowy (H₂S).
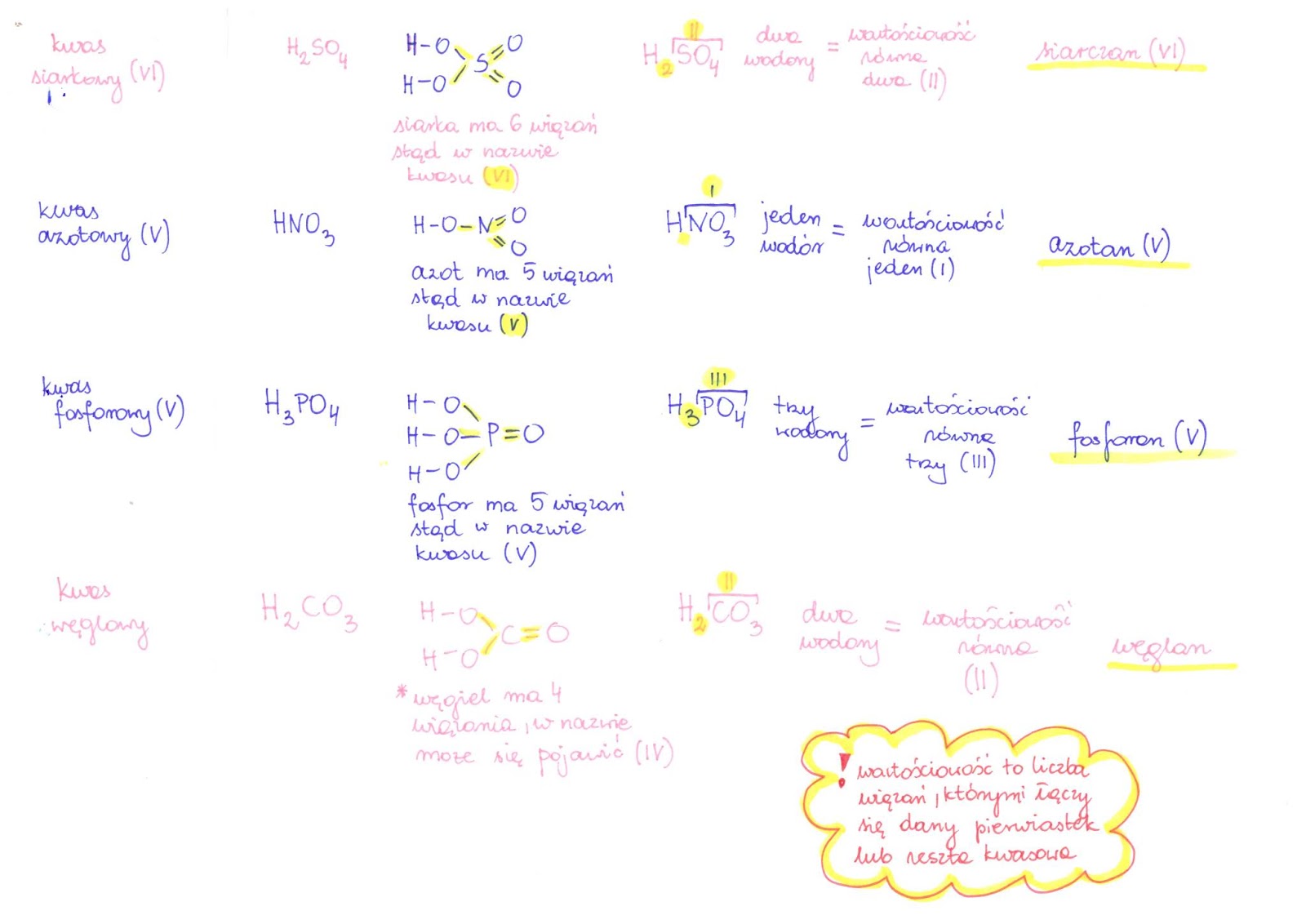
Kwasy tlenowe zawierają w swojej cząsteczce wodór, niemetal i tlen. Do tej grupy należą m.in. kwas siarkowy (H₂SO₄), kwas azotowy (HNO₃) i kwas fosforowy (H₃PO₄). Kwas siarkowy jest jednym z najważniejszych kwasów w przemyśle chemicznym. Kwas azotowy stosowany jest do produkcji nawozów i materiałów wybuchowych. Kwas fosforowy znajduje zastosowanie w produkcji nawozów i detergentów.
Właściwości kwasów
Kwasy mają charakterystyczne właściwości chemiczne. Reagują z metalami, zasadami, tlenkami metali i solami. Pamiętaj, że reakcje kwasów z metalami często prowadzą do wydzielania się wodoru!
Reakcja kwasów z metalami: Na przykład kwas chlorowodorowy reaguje z cynkiem, tworząc chlorek cynku i wodór: Zn + 2HCl → ZnCl₂ + H₂. Widać, że metal (cynk) zastępuje wodór w kwasie. Nie wszystkie metale reagują z kwasami. Te, które są mniej aktywne, jak na przykład miedź, nie reagują z większością kwasów.
Reakcja kwasów z zasadami: Ta reakcja nazywana jest reakcją zobojętniania. W jej wyniku powstaje sól i woda. Na przykład kwas chlorowodorowy reaguje z wodorotlenkiem sodu: HCl + NaOH → NaCl + H₂O. Sól kuchenna (NaCl) to właśnie produkt zobojętniania kwasu i zasady.
Reakcja kwasów z tlenkami metali: Na przykład kwas chlorowodorowy reaguje z tlenkiem miedzi(II): 2HCl + CuO → CuCl₂ + H₂O. W wyniku reakcji powstaje sól i woda. Tlenek miedzi (CuO) jest czarny, a chlorek miedzi (CuCl₂) ma kolor niebiesko-zielony. Dzięki temu można łatwo zaobserwować przebieg reakcji.
Reakcja kwasów z solami: Ta reakcja zachodzi, gdy powstaje słabszy kwas lub nierozpuszczalna sól. Na przykład kwas siarkowy reaguje z chlorkiem baru: H₂SO₄ + BaCl₂ → BaSO₄ + 2HCl. Siarczan baru (BaSO₄) jest nierozpuszczalny i wytrąca się z roztworu w postaci białego osadu.
Kwasy w życiu codziennym
Kwasy otaczają nas na co dzień. Są w jedzeniu, w napojach, w środkach czystości. Warto znać kilka przykładów, żeby lepiej zrozumieć ich rolę.
Kwas cytrynowy znajdziemy w cytrynach, limonkach i innych owocach cytrusowych. Nadaje im kwaśny smak i wykorzystywany jest jako naturalny konserwant. Dodaje się go również do napojów i słodyczy.
Kwas octowy, czyli ocet, używamy do przyprawiania potraw i konserwowania żywności. Jest również składnikiem wielu środków czystości.
Kwas węglowy powstaje, gdy dwutlenek węgla rozpuszcza się w wodzie. To on odpowiada za charakterystyczny smak napojów gazowanych.
Kwas solny, czyli kwas chlorowodorowy, znajduje się w naszym żołądku i pomaga w trawieniu pokarmów. Używany jest również w przemyśle do czyszczenia metali i produkcji różnych związków chemicznych.
Bezpieczeństwo podczas pracy z kwasami
Praca z kwasami wymaga zachowania ostrożności. Są to substancje żrące, które mogą powodować poważne oparzenia. Zawsze należy używać okularów ochronnych i rękawic. Jeśli kwas dostanie się na skórę, natychmiast przemyj ją dużą ilością wody.
Pamiętaj, żeby nigdy nie wlewać wody do stężonego kwasu. Zawsze wlewaj kwas do wody, powoli i mieszając. W przeciwnym razie może dojść do gwałtownej reakcji i rozpryskiwania się kwasu. To bardzo ważne, żeby uniknąć poważnych oparzeń.
Kwasy należy przechowywać w szczelnie zamkniętych pojemnikach, w chłodnym i dobrze wentylowanym miejscu. Należy unikać kontaktu kwasów z metalami, ponieważ może to prowadzić do korozji i wydzielania się wodoru, który jest gazem łatwopalnym.
Podsumowanie
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym są kwasy, jakie mają właściwości i jak bezpiecznie z nimi pracować. Pamiętaj o definicji, podziale na kwasy tlenowe i beztlenowe, reakcjach chemicznych i przykładach z życia codziennego. Powodzenia na sprawdzianie!